Sterbende Zellen, bedrohte Netzwerke
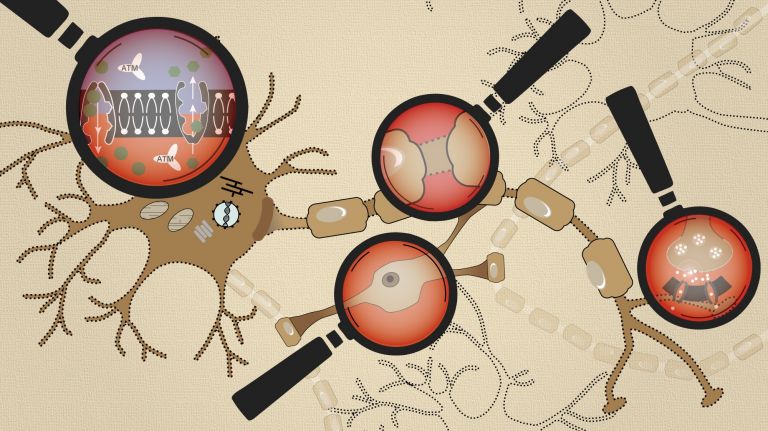
Ein Schlaganfall kappt die Sauerstoff- und Energiezufuhr der Hirnzellen. Ionen und Neurotransmitter geraten dann aus dem Lot.
Wissenschaftliche Betreuung: Prof. Dr. Ulrich Dirnagl
Veröffentlicht: 16.06.2021
Niveau: mittel
- Das Gehirn ist für bis zu 20 Prozent des körperlichen Energieumsatzes verantwortlich. Das liegt vor allem an der Arbeit der Synapsen, wo zum Austausch und zur Interpretation von Signalen ständig Ionen und Neurotransmitter die Zellmembran durchqueren.
- Bleibt infolge eines Schlaganfalls die Sauerstoffversorgung aus, fehlt auch die für diese Prozesse notwendige Energie in Form von Adenosintriphosphat (ATP). Der Transport von Neurotransmittern und Ionen wird dadurch gestört.
- Bei drastischem Sauerstoffverlust in der Kernzone eines Infarkts entsteht so ein Teufelskreis. Die energiehungrige Natrium-Kalium-ATPase kann nicht mehr genügend Natrium aus den Zellen herauspumpen, um die korrekte Spannung zwischen Zellinnerem und Umgebung aufrechtzuerhalten. Betroffene Neurone reagieren mit Entladung, was vielfach zur Ausschüttung von erregendem Glutamat führt.
- Bei zu viel Natrium im Zellinnern wechselt außerdem die Transportrichtung mancher Transporter, die sonst Glutamat wieder aufnehmen oder Kalziumionen aus der Zelle heraustransportieren. Dann scheiden Zellen noch mehr Glutamat aus und der Kalziumgehalt im Innern steigt.
- Zu viel Glutamat in der Zellumgebung stimuliert NMDA-Rezeptoren, die noch mehr Kalzium ins Zellinnere strömen lassen. Das wirkt zellschädigend und löst unter anderem den programmierten Zelltod aus.
- Die Überstimulierung pflanzt sich außerdem in Depolarisierungswellen immer weiter in umliegende Gehirnregionen fort. Auch Zellschäden können sich so in die Umgebung ausbreiten.
- Eine entscheidende Rolle spielen bei diesen Prozessen auch Gliazellen. Sie versagen beim Glutamatrecycling, und beginnen schlimmstenfalls sogar, ebenfalls Glutamat auszuschütten, was die Gesamtsituation noch verschärft.
Das Gehirn ist der Vielfraß unter den Organen. Obwohl es selbst im vergleichsweise hirnbetonten Organismus des Homo sapiens nur zwei Prozent des Körpergewichts ausmacht, beansprucht es bis zu 20 Prozent des gesamten Energieumsatzes. Energiehungrig sind vor allem die Nervenzellen. Damit sie Informationen verarbeiten und weiterleiten können, gilt es fortwährend Ionen und Neurotransmitter in Zellen hinein- und aus ihnen herauszutransportieren – und dieser Verkehr kostet eine Menge Treibstoff. Bleibt er infolge eines Schlaganfalls aus, hat das verheerende Folgen für die Nervenverbindungen und ganze neuronale Netzwerke.
Um die neuronalen Spritfresser möglichst effizient zu versorgen, ist der Stoffwechsel im Gehirn ganz auf die ergiebigste Form der Energiegewinnung eingestellt: die Zellatmung. Dabei generiert die Zelle mithilfe von Sauerstoff aus energiehaltigen Molekülen eine besonders reiche Ausbeute an ATP (Adenosintriphosphat), der energetischen Universalwährung biologischer Systeme.
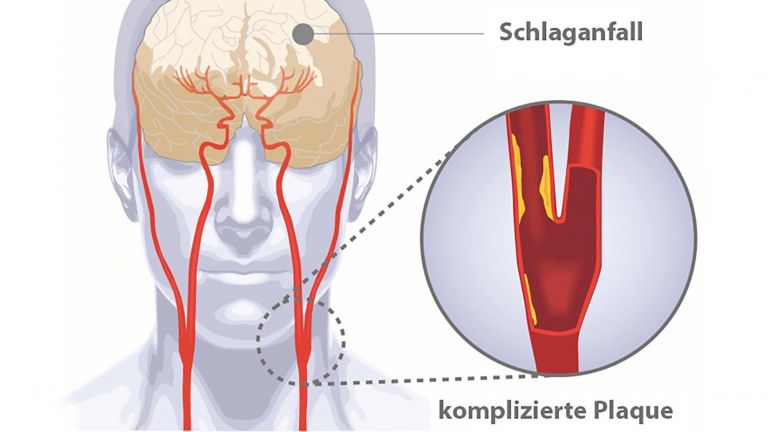
Bei einem ischämischen Schlaganfall unterbindet eine Gefäßblockade den Blutzustrom in bestimmte Gehirnregionen und kappt damit die Sauerstoffversorgung. In der Folge geraten die Gehirnzellen unter akuten metabolischen Stress – mit katastrophalen Auswirkungen: Ohne Sauerstoff entsteht nicht mehr genügend ATP. Und infolge des ATP-Mangels versagen bald essenzielle Mechanismen, die Nervenzellen für ihre Funktion und letztlich auch zum Überleben brauchen.
Der Untergang beginnt an der Synapse
“Als allererstes sind die ▸ Synapsen betroffen, denn sie verbrauchen die meiste Energie”, sagt Michel van Putten von der Universität Twente in den Niederlanden. Hier wird ATP verfeuert, um ▸ Neurotransmitter aus den Endknöpfchen der präsynaptischen Zellen freizusetzen und nach der Signalübertragung wieder zu recyceln. Den Löwenanteil der Energie – rund 85 Prozent – nehmen jedoch die Signalverarbeitung im postsynaptischen Bereich und der dafür notwendige Ionenaustausch über die Zellmembran in Anspruch. Dabei steht die Natrium-Kalium-ATPase im Zentrum. „Sie ist die Mutter aller Pumpen“, sagt Christine Rose von der Universität Düsseldorf. „Fällt sie aus, bedeutet das innerhalb von Minuten das Todesurteil für die Nervenzelle.“
Die Natrium-Kalium-Pumpe ist in Gehirnzellen ständig im Einsatz. Ihre Aufgabe ist es, die relativen Konzentrationsunterschiede zwischen den Natrium- und Kalium-Ionen im Zellinnern und außerhalb der Zelle aufrechtzuerhalten. Für jedes ATP-Molekül transportiert die Pumpe drei positiv geladene Natrium-Ionen aus der Zelle hinaus und zwei positive Kalium-Ionen hinein. Daraus resultiert eine ungleiche Ionen-Verteilung zwischen Zellinnerem und Zelläußerem – die Grundvoraussetzung für eine Signalweiterleitung ▸ Erfolgsgeheimnis Kommunikation .
Verlangsamt oder verhindert Sauerstoffmangel den ATP-Nachschub, beginnen fatale Kettenreaktionen. Schon bald entsteht ein dauerhafter Natrium-Überschuss in der Zelle. Die Zelle opfert noch vorhandene ATP-Reste für den letztlich vergeblichen Versuch, diesen Überschuss doch noch abzubauen. Der nunmehr gestörte Ionengradient führt wiederum dazu, dass weitere Pumpen in der Zellmembran in Mitleidenschaft gezogen werden.
Das betrifft etwa den Glutamat-Transporter, der normalerweise dafür sorgt, dass der erregende Neurotransmitter Glutamat nach der Ausschüttung an der Synapse wieder aus dem extrazellulären Raum entfernt, in die Synapse aufgenommen und somit recycelt wird. In welche Richtung der Glutamat-Transporter den Botenstoff befördert, hängt allerdings von der Natriumkonzentration ab: Wenn – wie im physiologischen Normalfall üblich – außerhalb der Zelle ein Natriumüberschuss vorherrscht, schleust der Transporter das Glutamat ins Zellinnere zurück. Steigt der Natriumgehalt im Zellinnern jedoch dauerhaft an, dreht sich die Transportrichtung allmählich um: Die Zelle sondert dann sogar noch mehr des Neurotransmitters nach außen ab. Mit der Zeit sammelt sich so immer mehr Glutamat außerhalb der Zellen an.
Der Teufelskreis der vergiftenden Erregung
Das überschüssige Glutamat in der Zellumgebung löst nun einen Prozess aus, den Experten als Exitotoxizität bezeichnen, als vergiftende Erregung. Der Neurotransmitter dockt an NMDA-Rezeptoren an – Transmembrankanäle, die wesentlich für die Übertragung erregender Signale verantwortlich sind. Das bewirkt, dass noch mehr Natrium-Ionen ins Zellinnere fließen und sich der Natriumüberschuss weiter verschärft. Gleichzeitig gelangen jetzt auch vermehrt Kalzium-Ionen in die Zelle, sodass nun auch der Kalzium-Spiegel übermäßig ansteigt.
Dieser Kalzium-Überschuss bedeutet letztlich den Todesstoß für die Zelle: Er aktiviert ihr Selbstmordprogramm. Zudem stört er die Funktion der Mitochondrien, was dazu führen kann, dass diese die ATP-Produktion endgültig stoppen, sie sogar in ATP-Spaltung umkehren und selbst Stoffe ins Zellinnere freisetzen, die das metabolische Ungleichgewicht verschärfen. Das schädigt die Zelle noch mehr und stimuliert ihr Selbstmordprogramm zusätzlich.
Ein weiterer Transporter, der die Richtung wechseln kann, macht alles noch schlimmer: der Natrium-Kalzium-Austauscher. Er schafft unter normalen Bedingungen ein Kalzium-Ion im Austausch gegen drei Natrium-Ionen aus der Zelle. Versagt jedoch, wie bereits geschildert, die Natrium-Kalium-Pumpe, läuft der Transport des Natrium-Kalium-Austauschers jedoch in die entgegengesetzte Richtung ab. Das erleichtert das Zellinnere zwar um einen Teil des Natriumüberschusses, lässt dafür aber den Kalzium-Spiegel noch stärker ansteigen – und befeuert damit den Zelltod.
Transportchaos greift auf Astrozyten über
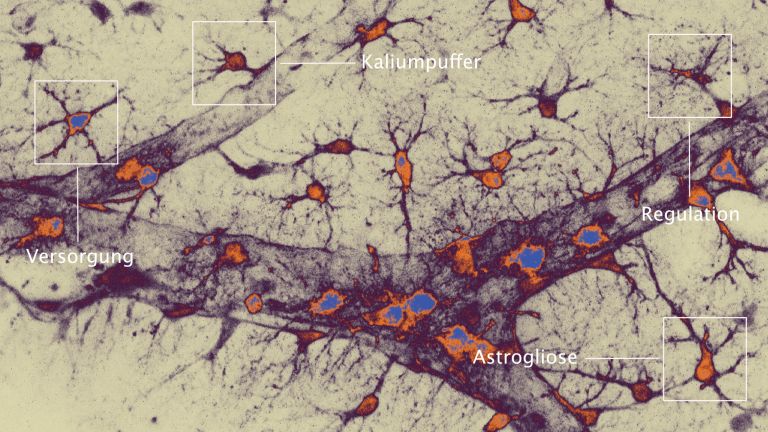
Das ungünstige Zusammenspiel der Ionen und Pumpen betrifft nicht nur die Neuronen sondern auch die sie unterstützenden Gliazellen. Besonders relevant für die Funktion der energiehungrigen Synapsen ist ihre Interaktion mit den sternförmigen Astrozyten, die ihre Fortsätze an die Dornfortsätze der postsynaptischen Nervenzellen schmiegen. Sie versorgen Neurone mit Energie aus dem Blut und ihren eigenen Glykogenreserven, saugen überschüssige Ionen und Neurotransmitter aus dem synaptischen Spalt und der synaptischen Umgebung auf und mischen sogar beim Signalaustausch mit. So eng ist die Verbindung zwischen Astrozyten und den prä- und postsynaptischen Terminalen der Neurone, dass man sogar von einer dreiteiligen Synapse spricht.
Da Astrozyten den Großteil des Transmitter-Recyclings übernehmen, können sie Neurone unter metabolischem Stress entlasten, indem sie den extrazellulären Glutamat-Überschuss zumindest teilweise aufnehmen. Allerdings stört der Energiemangel infolge eines Schlaganfalls auch die Ionen-Pumpen und Glutamat-Transporter der ▸ Astrozyten. Mit steigendem Natriumgehalt im Zellinnern können auch sie weniger Glutamat aufnehmen und drehen die Transportrichtung des Natrium-Kalzium-Austauschers um. Der Kalzium-Spiegel steigt nun auch im Innern der Astrozyten an. Dabei setzen Astrozyten, nachdem sie Glutamat aufgenommen haben, ohnehin bereits Kalzium-Ionen aus zellinternen Speicherkammern frei. Steigt das Kalzium-Level im Zellplasma der Astrozyten nun auf ein Übermaß an, beginnen sie selbst Glutamat in den extrazellulären Raum freisetzen. So heizen sie den exitotoxischen Teufelskreis noch weiter an.
Jenseits des Epizentrums
Während der totale Sauerstoffausfall in der Kernzone eines Infarkts innerhalb weniger Minuten zum Tod der dortigen Nervenzellen führt, überleben die Zellen in den angrenzenden Zonen mit etwas Glück. Das Gebiet rund um den Infarktkern wird auch als Penumbra (Halbschatten) bezeichnet. Hier bricht die Blut- und Sauerstoffversorgung nicht vollständig zusammen. Vielmehr herrscht hier lediglich ein mehr oder minder schwerer Sauerstoff- und Energiemangel, auf den die Zellen auch prompt reagieren. “Schon nach etwa einer Minute setzt die elektrische Aktivität in der Penumbra aus, weil die Synapsen die Arbeit einstellen”, sagt van Putten. Zunächst verstummt die Signalübertragung präsynaptisch, wenn Nervenzellen aufgrund des ATP-Mangels keine Neurotransmitter mehr freisetzen. Sowohl die ausbleibenden Signale als auch der Energiemangel selbst wirken sich sodann auch postsynaptisch aus.
Von diesen Aussetzern können sich die Zellen zwar erholen. Aber ob, wann und wie dies gelingt, hängt von mehreren Faktoren ab. Erstens kann sich die Funkstille in der Penumbra paradoxerweise in ein tödliches Gegenteil verkehren: nämlich dann, wenn die übermäßige Glutamat-Ausschüttung der gestressten Zellen in der Kernzone die vernetzten Neurone in der Penumbra erreicht. In der Folge entstehen so genannte Depolarisationswellen, die sich in den Minuten bis Tagen nach dem Schlaganfall in Kettenreaktionen immer weiter in die umliegenden Gehirnregionen ausbreiten und dort zu weiteren exitotoxischen Gewebeschädigungen führen können.
Ein Tsunami breitet sich aus
Solche Wellen werden zum zerstörerischen Tsunami, indem sie weiteres, stark erregendes Glutamat freisetzen, das die flussabwärts vernetzten Zellen stimuliert. Da das freigesetzte Glutamat noch mehr Natrium in die postsynaptischen Zellen einströmen lässt, springen auch dort die energiehungrigen Natrium-Kalium-Pumpen an, um das Ionengleichgewicht wiederherzustellen. Der Energiemangel verschärft sich. “Für Nervenzellen, deren Überleben aufgrund des Sauerstoffmangels ohnehin schon am seidenen Faden hängt, kann dieser zusätzliche ATP-Verbrauch den Tod bedeuten”, sagt Gabor Petzold vom Deutschen Zentrum für Neurodegenerative Erkrankungen in Bonn und der Universität Bonn. “Nach der Depolarisierungswelle ist der Akku dann endgültig leer.”
An dieser Stelle kommen erneut die Astrozyten ins Spiel. Aufgrund ihrer bereits erwähnten intimen Beteiligung an der Funktion der Synapsen beeinflussen sie auch, ob Depolarisierungswellen entstehen und wie heftig diese ausfallen. Das könnte eines Tages neue therapeutische Optionen eröffnen. In Experimenten mit Mäusen gelang es Petzolds Team, den Kalzium-Anstieg in den Astrozyten pharmakologisch zu blockieren und so das Ausmaß der Depolarisierungswellen und Zellschädigungen zu mindern. “Wenn man aufbauend auf diesem Mechanismus ein Medikament entwickeln könnte, wäre das phänomenal, da man Depolarisierungswellen auch noch Tage nach dem Schlaganfall behandeln könnte”, sagt Petzold. Bislang zugelassene Medikamente müssen innerhalb der ersten Stunden nach dem Infarkt gegeben werden.
Empfohlene Artikel
Lernen vom Generalstreik der Synapsen
Ein zweiter Faktor im Zusammenspiel zwischen Astrozyten, Neuronen, Ionen und Neurotransmittern ist die genaue Konfiguration der Räume zwischen den Zellen. “Wie gut Astrozyten Glutamat recyclen, hängt entscheidend davon ab, welchen Zugang sie zum extrazellulären Raum um Synapsen haben”, sagt Christian Henneberger von der Universität Bonn. Um das aus dem synaptischen Spalt austretende überschüssige Glutamat aufzusaugen, müssen die Astrozyten ihre Fortsätze passend platzieren können. Ragen die Fortsätze nicht nahe genug an eine Synapse heran oder bleiben sie im Vergleich zur Synapse klein, schwappt über den extrazellulären Raum auch mehr Glutamat zu benachbarten Zellen und Synapsen.
Bei einem Schlaganfall verengt sich der extrazelluläre Raum, vermutlich weil die aus dem Gleichgewicht geratenen Ionengradienten die Zellen anschwellen lassen. Dies scheint dazu beizutragen, dass Astrozyten weniger erfolgreich Glutamat recyceln. Es könnte auch mit bedingen, dass ältere Menschen, deren extrazellulärer Raum im Vergleich zu Jüngeren ohnehin enger ist, häufig schlechtere Prognose nach einem Schlaganfall haben, wie Christine Rose vermutet.
Ein dritter Faktor, der den weiteren Verlauf nach dem synaptischen Streik beeinflussen kann, sind dessen Spätfolgen für die Funktion neuronaler Netzwerke. Viele Nervenzellen können zwar trotz vorübergehend eingestellter oder gestörter Synapsenfunktion auch eine über Stunden reduzierte Sauerstoffzufuhr überleben. Wie erfolgreich sie ihre Funktion innerhalb der nächsten Tage wieder regenerieren, hängt allerdings auch davon ab, wie lange und nachhaltig die synaptischen Prozesse gestört waren. Infolge der Funkstille verändern Synapsen sich nämlich auch strukturell. Die Fortsätze an den präsynaptischen Axonknöpfchen und den postsynaptischen Dornenfortsätzen schrumpfen. Dadurch werden die synaptischen Verbindungen geschwächt.
Erregende Synapsen: Krampfanfälle vs Plastizität
Mithilfe von Zellkulturstudien erbrachten van Putten und seine Kollegen den Beweis, dass hemmende Synapsen sich verhältnismäßig stärker zurückbilden als erregende Synapsen. Dies könnte daran liegen, dass die Netzwerke selbst hemmende Synapsen herunter- und erregende Synapsen heraufregulieren, um die aufgrund des Sauerstoffmangels drastisch reduzierte Signalaktivität nicht noch weiter zu unterdrücken. Dieses veränderte Verhältnis von hemmenden und erregenden Synapsen könnte eine Erklärung dafür bieten, warum manche Schlaganfallpatienten in der Erholungsphase, wenn die Sauerstoffversorgung wieder hergestellt ist, einen besonders erregbaren Cortex haben und zu Krampfanfällen neigen.
Erregende Synapsen fördern aber auch synaptische Plastizität, und das ist für den langfristigen Erhalt von eigentlich noch überlebensfähigen Neuronen wichtig, betont van Putten: „Neurone brauchen die synaptische Kommunikation mit ihren Nachbarn, um zu überleben.” Bemühungen, die Synapsen rechtzeitig nach einem Schlaganfall wieder in Schwung zu bringen, könnten daher auch die Erholungschancen verbessern, da weniger Zellen infolge von Kommunikationsausfällen sterben. Diesen Ansatz testen van Putten und seine Kollegin Jeannette Hofmeijer beispielsweise in Experimenten und klinischen Studien, in denen sie die synaptische Aktivität mithilfe des Hormons Ghrelin stimulieren. “Der übliche Ansatz, Schlaganfallpatienten zu sedieren und die synaptische Aktivität so gering zu halten, ist vielleicht gar nicht immer sinnvoll”, so van Putten.
Viele Fragen dazu, wie das exakte zeitliche und räumliche Zusammenspiel zwischen Neuronen und Astrozyten in den verschiedenen Phasen nach einem Schlaganfall das Überleben der Zellen beeinflusst, bleiben offen, doch es zeichnet sich ab, dass die Prozesse an den Synapsen eine entscheidende Rolle spielen, betont Christine Rose: “Wir müssen die Zusammenhänge noch genauer untersuchen, um besser zu verstehen, was genau die Zellen und Netzwerke nach einem Schlaganfall an Kipp-Punkte bringt – und wie man diese umschiffen kann.”
Zum Weiterlesen
- Hofmeijer J, van Putten MJ: Ischemic cerebral damage: an appraisal of synaptic failure. Stroke. 2012 Feb; 43(2):607-15 ( zum Volltext ).
- Felix L, et al.: Sodium Fluctuations in Astroglia and Their Potential Impact on Astrocyte Function. Front Physiol . 2020 Aug; 11:871 ( zum Volltext ).