Die Rolle der Astrozyten beim Schlaganfall
Astrozyten sind universelle wichtige Hilfszellen des Nervensystems. Auch an der Pathologie des Schlaganfalls sind sie wesentlich beteiligt – und massiv von ihm betroffen.
Wissenschaftliche Betreuung: Prof. Dr. Ralf Stumm
Veröffentlicht: 17.06.2021
Niveau: mittel
- Nach einem ischämischen Schlaganfall beginnen vier wesentliche Schadensprozesse: Übererregung, Peri-Infarkt Depolarisationen, Entzündung und programmierter Zelltod (Apoptose).
- Astrozyten sind von allen Schadensprozessen betroffen und an allen beteiligt. Zugleich können Astrozyten regenerative Einflüsse ausüben.
- Aktuelle Forschungen versuchen, astrozytäre Einflüsse so zu regulieren, dass die regenerativen Einflüsse überwiegen und dies als therapeutische Unterstützung eingesetzt werden kann.
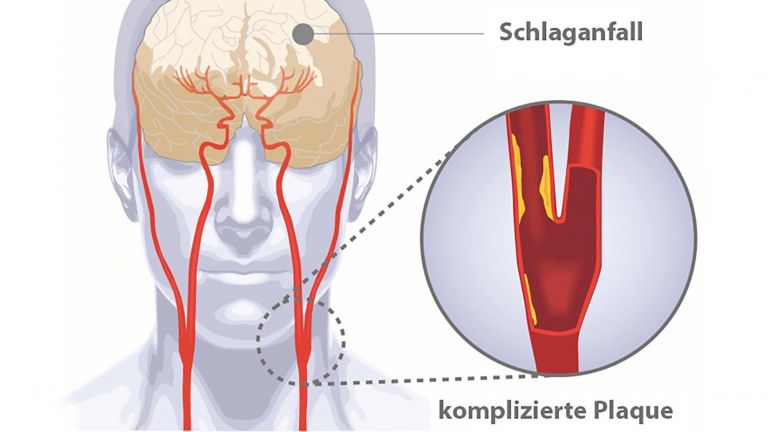
Eigentlich klingt es ganz einfach: Beim ischämischen Schlaganfall verhindert ein verstopftes Gefäß, dass ein Gehirnbereich ausreichend mit Blut versorgt wird. Bleibt der Blutfluss unterbrochen, sterben die Zellen ab und der Funktionsverlust kann häufig trotz intensiver Rehamaßnahmen nicht wiederhergestellt werden.
Hinter dieser scheinbar einfachen Erklärung verbirgt sich eine Vielzahl zellulärer und biochemischer Reaktionen, deren Details ungezählte Neurowissenschaftler beschäftigen.
Um die Gründe aufzudecken, warum Gehirnzellen ihre Funktion einstellen, absterben und nicht regeneriert werden können, stellten sich drei Neurowissenschaftler die Frage, was ab dem Stopp der Blutversorgung passiert. Ulrich Dirnagl – heute Direktor der Abteilung Experimentelle Neurologie an der Charité Universitätsmedizin Berlin beschrieb mit seinen Kollegen Constantino Iadecola und Michael Moskowitz bereits 1999 in dem viel beachteten Übersichtsartikel "Pathobiology of ischaemic stroke: an integrated view" die vier wesentlichen Schadensmechanismen, die nach einem Schlaganfall ablaufen. In einer berühmt gewordenen Abbildung zeichneten sie deren Abfolge - Übererregung, wellenförmige Ausbreitung des Chaos (Peri-Infarkt Depolarisationen), Entzündung, und programmierter Zelltod – als einzelne, einfache Kurven, die über die Zeit abliefen und jeweils Schaden entsprechend ihrer Dauer (Breite) und Schwere (Höhe) anrichteten.
Buntes Chaos statt Schwarz-Weiß-Denken
Was hat sich in den 20 Jahren seit der Veröffentlichung verändert? Prof. Gabor Petzold leitet die Arbeitsgruppe neurovaskuläre Erkrankungen am Deutschen Zentrum für Degenerative Erkrankungen in Bonn. Er drückt es so aus: "Das Bild wurde seither nicht wesentlich korrigiert. Die Schadensmechanismen und ihre Gipfel, das hat weiterhin Gültigkeit. Aber die durch die Darstellung angedeutete Trennung der Phasen, die gibt es wohl so nicht. Die Schadensmechanismen laufen eher parallel zueinander ab." Und Arthur Liesz, Professor für Schlaganfall-Immunologie am Institut für Schlaganfall- und Demenzforschung der LMU München fügt an: "Früher sahen wir nur schwarz-weiß, heute zeigt sich uns ein detaillierteres Bild"." Parallele, statt getrennte Phasen detaillierter zu malen, das hört sich wenig beeindruckend an. Doch es steht für die fundamentale Erkenntnis, dass im Gehirn alles mit allem zusammenhängt. Dass es Bösewichte vielleicht gar nicht gibt, ja, dass sich selbst Gut und Böse nicht immer unterscheiden lassen.
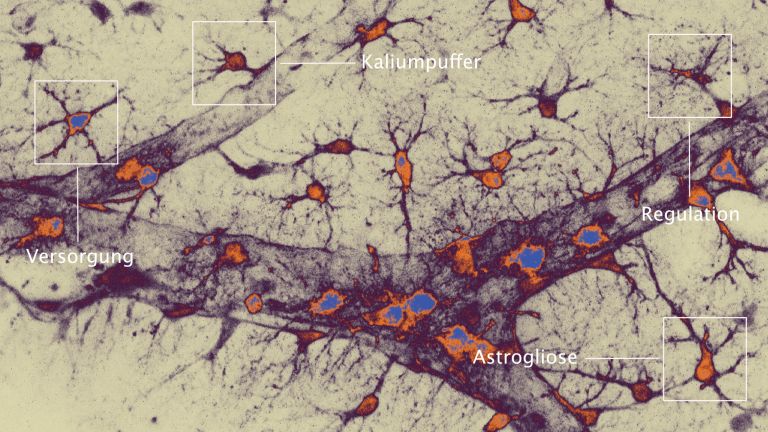
Zunächst einmal: Im Gehirn gibt es nicht nur Neurone. Beim Menschen bilden Neurogliazellen über die Hälfte der Zellen des Nervengewebes. Weil sie elektrisch inaktiv sind, werden sie leicht übersehen. Es gibt vier Arten Neuroglia: Oligodendrozyten umhüllen die Axone mit Myelin und erhöhen so die Signalgeschwindigkeit. Dann gibt es eine kleine Gruppe von Vorläuferzellen, die Oligodendrozyten bilden, die NG2-Glia. Ihren Namen verdanken sie der Tatsache, dass sie bestimmte Proteoglykane (NG2) tragen. Den dritten Typ von Neuroglia bilden die an der Immunabwehr beteiligten Mikroglia (sie werden im folgenden Artikel beschrieben. Und schließlich die Astrozyten, deren Rolle nach dem Schlaganfall hier beschrieben wird.
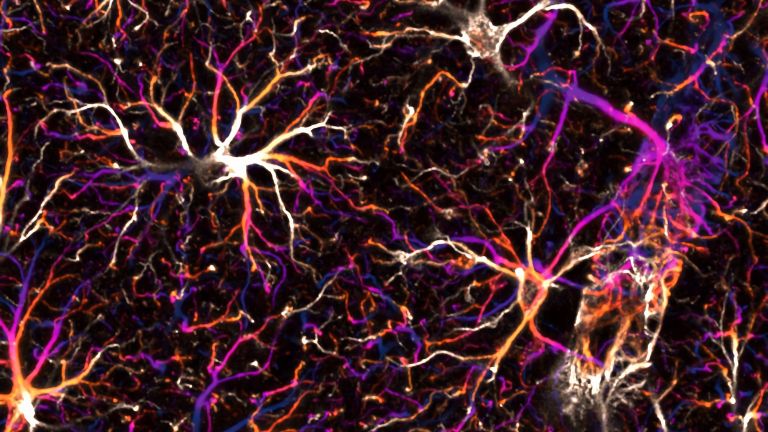
Astrozyten sind überall im Nervensystem vorkommende ▸ grundlegende Helferzellen. Prof. Helmut Kettenmann leitet die Arbeitsgruppe Zelluläre Neurowissenschaften am Max-Delbrück-Zentrum für Molekulare Medizin in Berlin. Er ist einer der renommiertesten Experten für Neuroglia und fasst die Funktion der Astrozyten unter Normalbedingungen so zusammen: "Zunächst versorgen sie Neurone. Dazu stehen sie in engem Kontakt mit Blutgefäßen und Synapsen. An der Synapse empfangen sie die neuronale Aktivität, am Blutgefäß regulieren sie die Gefäßweite entsprechend. Aus den Gefäßen empfangen sie Glukose, die sie zu Laktat transferieren und an die Neurone weiterreichen. An den Synapsen puffern sie das ausgeschüttete Kalium weg, nehmen die Transmitter wieder auf und führen beides zurück an die Neurone. Und schließlich sind sie auch an der Plastizität der Synapsen beteiligt." Sie sind wie Hausmeister, unverzichtbar und irgendwie bei allem dabei. Wird die Energieversorgung jedoch unterbrochen, so sind die Astrozyten gleich an mehreren Schadensprozessen beteiligt:
1. Übererregung.
Neurone sind geladen, das kostet Energie. Während eines Aktionspotentials verlieren sie die Ladung für einen Sekundenbruchteil. Danach muss sie wiederhergestellt und bis zum nächsten Aktionspotential aufrechterhalten werden. Ohne Energie depolarisieren die Zellen dauerhaft. Sie verlieren dann viel Kalium und schütten alle Botenstoffe aus, die sie haben. Die Neurone gehen an der Übererregung zugrunde und die Astrozyten können das nicht verhindern, weil sie ebenfalls geschwächt sind.
2. Peri-Infarkt-Depolarisationen.
Am Rand des betroffenen Gebiets, der so genannten Penumbra, können die Zellen nach der Entladung ihre Polarität wiederherstellen. Doch das kostet ihre letzte Energie. Schwappen dann Kalium und Transmitter aus dem Infarktkern bis zu ihnen, kommt es zu erneuten Entladungen. Es entstehen mehrere Entladungswellen pro Stunde, die Peri-Infarkt Depolarisationen, die mit dem sich vergrößernden Infarktgebiet zunehmen. In einer 2017 erschienenen Veröffentlichung zeigten Cordula Rakers and Gabor Petzold, dass Astrozyten an diesem Schadensprozess ursächlich beteiligt sind. Sie reagieren auf die von Neuronen ausgeschütteten Botenstoffe. Im Zellinneren der Astrozyten steigt der Kalziumspiegel, und sie beginnen nun ebenfalls Botenstoffe auszuschütten. Dies führt dazu, dass weitere Wellen über ihre Nachbarn, die ohnehin schon geschwächten Neurone, hinwegrollen.
3.Entzündung.
Astrozyten sind als Generalisten auch an Immun-Reaktionen beteiligt. Im Rahmen einer Entzündung des Gehirns (verlinken auf 5.5.5. Entzündungsprozesse) schwellen sie an und verändern ihre Proteinproduktion. Bei dieser „reaktiven Astrogliose“ bilden die Astrozyten eine Art Narbe, die abgestorbenes und gesundes Gewebe voneinander trennt. Neurologe Petzold glaubt, dass dies die Zuwanderung überschüssiger Immunzellen aus dem Blut, und damit auch die Ausweitung des Schadens begrenzt. „Dann produzieren die Astrozyten anti-entzündliche Substanzen, so genannte Zytokine, wie Interleukin 10 und TGF- b , die eine überschießende Immunreaktion verhindern sollen."
Kompliziert wird die Analyse dadurch, dass eine Entzündung auch ihr Gutes hat. Sie reduziert den Gewebeschaden, indem sie tote Zellen und -trümmer reduziert. Wenn die nicht entsorgt werden, verrotten sie an Ort und Stelle und richten noch mehr Schaden an. Tatsächlich machen Astrozyten laut Petzold mehr, als nur zu mauern und zu dämpfen: "Sie schütten auch so genannte trophische Substanzen aus, also solche, die den überlebenden Neuronen die Chance geben sollen, wieder neu zu wachsen und neu Synapsen zu bilden." Andererseits gibt es auch Subpopulationen unter den Astrozyten, die in einer bestimmten Phase der Erkrankung für Neurone giftig wirken können.
Empfohlene Artikel
Zu viele Schalter
In diesem hochkomplexen neu gemalten Bild der Ereignisse nach einem Schlaganfall tragen Astrozyten auf ihrer Oberfläche unzählige Schalter, die alle möglichen Prozesse in ihnen auslösen können. Die Art der Umgebung und die Bedingungen, die dort herrschen, drücken jeweils einzelne oder mehrere Schalter. Und je nachdem welche wie lange gedrückt werden, entsteht eine spezifische Mischung aus Oberflächenstrukturen und Proteinen auf und in den Zellen, was sich wiederum auf ganz bestimmte Situationen in der Summe positiv oder negativ auswirken kann.
Gerne würden die Forscher zum richtigen Zeitpunkt die richtigen Schalter drücken – allerdings sind diese zum Teil auch auf den Neuronen vorhanden. Tatsächlich gibt es bisher keinen bekannten Schalter, den NUR Astrozyten tragen. Das macht die Forschung an Markern für Diagnose oder Therapie so schwer. Welche Aktivierungsmuster machen aus einem Astrozyten eine neurotoxische, welche eine neuroprotektive Zelle? Auch Gabor Petzold sucht mit seinem Team nach solchen astrozytären Markern; nach Schaltern, die Astrozyten dazu bringen könnten, neuroprotektiv zu wirken. Ein Kandidat ist STAT3. "Das ist ein Transkriptionsfaktor in Astrozyten. Wenn wir es irgendwann irgendwie schaffen könnten, diesen Faktor innerhalb des Gehirns zu erreichen und spezifisch nur in Astrozyten zu hemmen, dann könnte das ein neuroprotektives Expressionsprofil entwickeln. Unserer jetzigen Vorstellung nach könnte dies die Situation für Patienten verbessern. Aber das ist Zukunftsmusik."
4. Programmierter Zelltod.
Zellen haben zwei Möglichkeiten zu sterben. Unordentlich oder ordentlich. Bei der unordentlichen Nekrose zerfallen Zellen, ihr Inneres dringt nach außen, Entzündung ist vorprogrammiert. Bei der ordentlichen Apoptose verpackt sich die Zelle Stück für Stück selber in Pakete, nichts dringt in den Extrazellularraum, keine Entzündung folgt. Wer drückt den Schalter, der die kontrollierte Selbstzerstörung auslöst? Und wie verhindert man das?
Laut Petzold haben viele Labore weltweit diesen Schalter gesucht: "Idee war, dass das Signalwege auslöst, die am Ende dazu führen, dass Neurone sterben. Man hat diesen Schalter bis heute nicht gefunden und ich glaube auch nicht, dass so etwas existiert. Ich glaube nicht, dass Astrozyten oder auch Mikrogliazellen zu Killern mutieren und losziehen und Neurone töten." Es scheint, dieses Bild war dann doch zu einfach gemalt. Also gibt es auch beim letzten Prozess keine Bösewichte? Es ist allein der andauernde Energiemangel und die chaotische Kombination molekularer Signale, die Neurone dazu bringen, Suizid zu begehen? bestätigt Petzold auf Nachfrage. Das sei unbefriedigend, aber eine bessere Antwort habe er nicht."
Das neue bunte Bild der Vorgänge nach Schlaganfall ist komplex, dass sie alle parallel ablaufen und sich gegenseitig beeinflussen, macht es nicht einfacher. Aber das Bild ist noch nicht fertig. Verbirgt sich die Antwort in anderen Zelltypen? Die Rolle der Mikroglia nach Schlaganfällen wird ▸ im folgenden Text behandelt.
Zum Weiterlesen:
- Dirnagl U et al.: Pathobiology of ischaemic stroke: an integrated view, TinS, 1999 Sep; 22(9): 391-7. [https://pubmed.ncbi.nlm.nih.gov/10441299/]
- Neuroglia, Third Edition, hg von Helmut Kettenmann und Bruce Ransom, Oxford University Press (2012).
- Rakers C, Petzold G: Astrocytic calcium release mediates peri-infarct depolarizations in a rodent stroke model, J Clin Invest. 2017 Feb 1; 127(2): 511–516. [https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5272189/pdf/jci-127-89354.pdf]
- Liesz A et al.: Regulatory T cells are key cerebroprotective immunomodulators in acute experimental stroke, Nat Med 2009 Feb; 15(2): 192-9. [https://pubmed.ncbi.nlm.nih.gov/19169263/]
- Populärwissenschaftliches Buch zum Thema, vom Autor dieses Artikels: Ich glaub, mich trifft der Schlag, Ulrich Dirnagl, Jochen Müller, Droemer, München (2016)