Entzündungsprozesse: Nach Schlaganfällen ist „High Life“ im Gehirn
Ein Schlaganfall gilt nicht als klassische Entzündungskrankheit. Doch er führt zu einer heftigen Immunreaktion – und zwar im ganzen Körper. Diese Prozesse zu verstehen, liefert Ansatzpunkte für neue Behandlungsmöglichkeiten.
Wissenschaftliche Betreuung: Prof. Dr. Andreas Meisel
Veröffentlicht: 16.06.2021
Niveau: mittel
- Ein Schlaganfall löst im Gehirn eine starke Immunreaktion aus: Mikroglia werden aktiviert und locken Immunzellen an. Dadurch wird das Hirngewebe noch stärker beschädigt.
- Die Entzündungsreaktion bleibt lebenslang bestehen – und zwar nicht nur im Gehirn.
- Die Entzündung ist nicht nur schlecht: Bestimmte Populationen von Immunzellen fördern die Regeneration.
- Auch das Blutgerinnungssystem spielt eine Rolle: Die Prozesse beeinflussen sich gegenseitig. Durch einen Schlaganfall wird ein erneutes Gerinnsel wahrscheinlicher.
- Es gilt, die Vorgänge noch genauer zu verstehen, um gezielt eingreifen zu können.
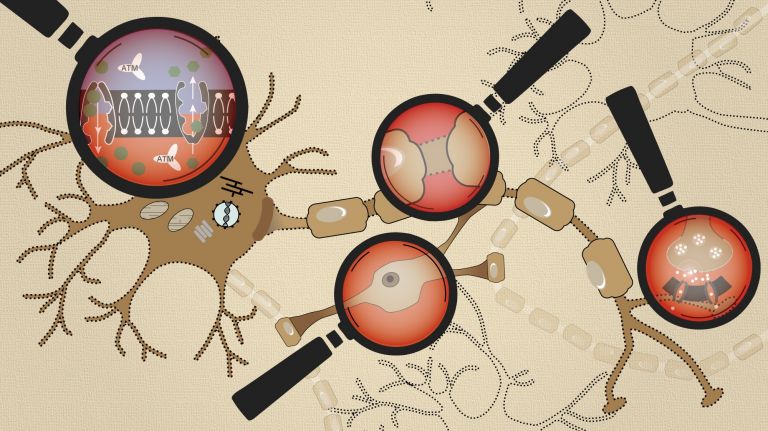
Das Inflammasom ist ein wichtiger Teil unseres angeborenen Immunsystems. Erstmals beschrieben wurde der Multi-Proteinkomplex im Jahr 2002 von einem Team um den Schweizer Biochemiker Jürg Tschopp. Seine einzelnen Komponenten liegen im Inneren von praktisch allen Immunzellen bereit. Detektieren die Sensoren des Inflammasoms, das sind bestimmte Rezeptorproteine, Entzündungssignale, so setzt es sich der Multi-Proteinkomplex rasend schnell zusammen. Dazu muss zunächst eine Protease (Caspase-1) das Interleukin 1 (IL-1) zurechtschneiden. Das entzündungsfördernde Zytokin liegt in der Zelle in seiner inaktiven Form vor, damit das System nicht aus Versehen aktiviert werden kann. Es ist quasi der Gate Keeper. Kommt es tatsächlich zu einer Infektion oder Entzündung, bildet das Inflammasom außerdem Poren in der Zellmembran, sodass das fertige IL-1 rasch aus der Zelle ausgeschleust werden kann. Dadurch ist dieses Zytokin als einer der ersten Entzündungsbotenstoffe vor Ort und stößt viele weitere Entzündungsreaktionen an, zum Beispiel die Produktion von Interferonen. Forscher sind sich mittlerweile sicher, dass das Inflammasom auch bei der Neuroinflammation infolge von Schlaganfällen eine wichtige Rolle spielt.
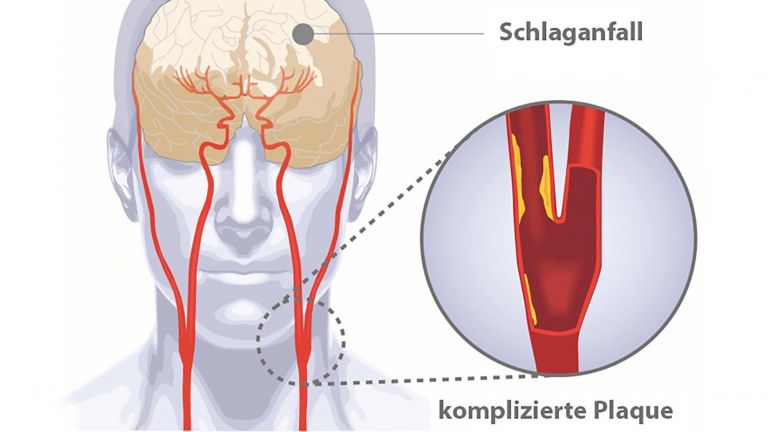
Jedes Jahr ereignen sich allein in Deutschland etwa 250.000 Schlaganfälle – das entspricht etwa einem alle zwei Minuten. Am häufigsten ist der sogenannte ischämische Schlaganfall. Dabei kommt es zu einer Durchblutungsstörung des Gehirns. Auslöser sind Blutgerinnsel (Thromben) oder arteriosklerotische Plaques, also Fettablagerungen, die jene Arterien verstopfen, die das Gehirn mit Blut und Sauerstoff versorgen. Die Verstopfung kann direkt im Gehirn entstehen oder außerhalb, und dann über den Blutstrom ins Gehirn gelangen. Die Folge: Durch den Gefäßverschluss bekommen die Nervenzellen nicht mehr ausreichend Sauerstoff und Nährstoffe und sterben ab. Je nachdem, welche Areale betroffen sind, treten bestimmte neurologische Symptome auf, etwa Sprach- oder Sehstörungen sowie halbseitige Lähmungen. Was aber spielt sich innerhalb des Gehirns ab? Und vor allem: Was hat unser Immunsystem damit zu tun?
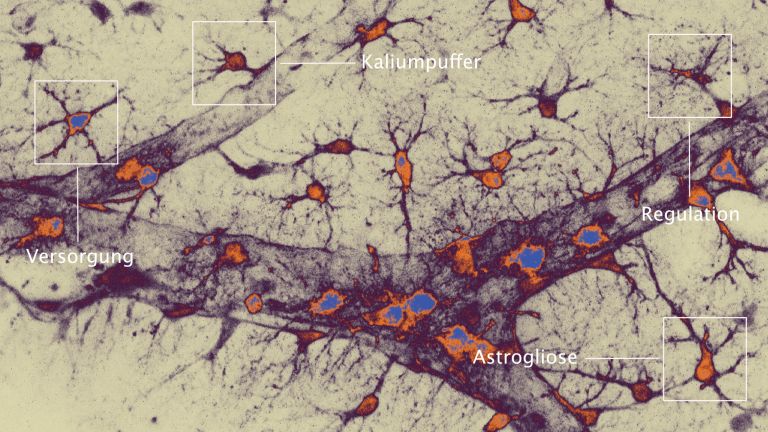
Eine ganze Menge. Ein Schlaganfall löst eine Immunreaktion im Gehirn aus. Das ist eigentlich nichts Ungewöhnliches. „Jede Gewebeverletzung verursacht eine Entzündung“, sagt Arthur Liesz vom Klinikum der Universität München. Er ist Professor am Institut für Schlaganfall- und Demenzforschung. Im Gehirn laufen Entzündungen aber etwas anders ab als im Rest des Körpers. Das liegt zum Beispiel daran, dass das Gehirn seine eigenen Immunzellen besitzt: Mikroglia. Die „Immunpolizei“ des Gehirns reagiert auf jegliche Veränderung der Gewebshomöostase. Durch Stress, zum Beispiel den Sauerstoffmangel bei einem Schlaganfall, werden die Zellen aktiviert. „Das ist quasi das Erste, was passiert – innerhalb von Minuten“, erklärt Liesz.
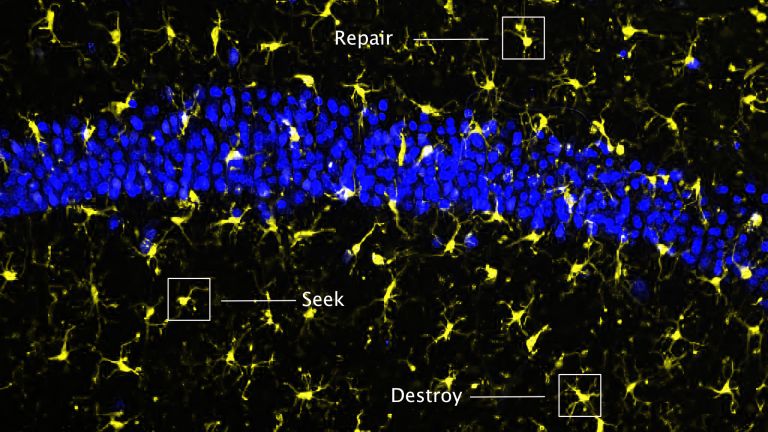
Die Mikroglia drehen durch
Die Aktivierung bewirkt, dass die Mikroglia sich verändern. Sie interagieren verstärkt mit anderen Zellen in ihrer Nachbarschaft und bauen Synapsen ab, die durch den Sauerstoffmangel beschädigt wurden. Außerdem produzieren sie bestimmte Zytokine und Chemokine. „Sie generieren ein lokales, inflammatorisches Milieu“, fasst Liesz zusammen. Davon werden weitere Entzündungszellen, zum Beispiel Neutrophile, Granulozyten, Makrophagen sowie T- und B-Zellen aus dem Blut angelockt. Es ist sozusagen „High Life“ im Gehirn. Eingewanderte Immunzellen, die das Gehirn unter anderen Umständen relativ rasch wieder verlassen, bleiben dort über Tage und Wochen hinweg. Das Gewebe nimmt dadurch weiteren Schaden.
Weshalb reagiert unser Immunsystem derart über? Und: Ist die Reaktion ausschließlich schädlich? „Nein“, sagt Liesz. „Einige Komponenten sind durchaus protektiv.“ Sie stoßen Regenerationsprozesse an und fördern die neuronale Plastizität. Das sei aber nicht der primäre Zweck dieser Mechanismen, erklärt der Neurologe weiter. Vielmehr ist unser Immunsystem darauf ausgerichtet, Infektionen zu erkennen und entsprechend zu reagieren. Oft ist es aber einfacher, den Untergang von Gewebe – eine Nekrose – zu detektieren als den eigentlichen Krankheitserreger. Darum springt unser Immunsystem auch an, wenn Nekrosen vorliegen, die nichts mit Viren oder Bakterien zu tun haben – zum Beispiel nach einem Schlaganfall.
Schlaganfall
Schlaganfall/Apoplexia cerebri/stroke
Bei einem Schlaganfall wird das Gehirn oder Teile davon nicht mehr ausreichend mit Blut versorgt, wodurch Sauerstoff- und Glukoseversorgung beeinträchtigt sind. Die häufigste Ursache ist ein Verschluss einer Arterie (ischämischer Schlaganfall), seltener eine Blutung (hämorrhagischer Schlaganfall). Typische Symptome sind plötzliche Sehstörungen, Schwindel, Lähmungen, Sprach- oder Sensibilitätsstörungen. Langfristige Folgen können verschiedene Gefühls-, Bewegungs- und kognitive Einschränkungen sein.
Der Schlaganfall geht, die Entzündung bleibt
Ein weiteres Problem, – vielleicht das größte: Die Neuroinflammation bleibt bestehen. „Wenn man sich schneidet oder gar einen Herzinfarkt erleidet, ist die Entzündung irgendwann vorbei“, sagt Liesz. Nicht so im Gehirn: „Die Mikroglia eines Schlaganfallpatienten werden bis zu seinem Lebensende aktiviert sein.“ Auch die Konzentration an T- und B- Zellen im Gehirn bleibt dauerhaft erhöht. Warum diese Entzündungsreaktion nicht nachlässt, sei bisher kaum verstanden, so der Neurologe. Zudem führt ein Schlaganfall nicht nur zu einer Entzündung innerhalb des Gehirns: „Es kommt zu überraschend starken und langanhaltenden Veränderungen im peripheren Immunsystem“, sagt Liesz. So wirke sich ein Schlaganfall beispielsweise auch auf das Knochenmark, die Milz, den Darm und die Lymphknoten aus. Wie und weshalb, das versuchen Liesz und seine Kollegen herauszufinden.
Liesz‘ Team ist Teil der DFG-geförderten Forschungsgruppe ImmunoStroke . An den Projekten sind Forschende aus München, Essen, Hamburg und Münster beteiligt. Die Sprecherrolle hat Christoph Kleinschnitz inne, er ist Direktor der Klinik für Neurologie am Universitätsklinikum Essen. In Studien mit Mäusen gelang es seinem Team bereits nachzuweisen, dass den T-Zellen bei diesen Prozessen eine besonders wichtige Rolle zukommt. „In der sehr frühen Phase verstärken sie den Schaden, verschlechtern also den Ausgang eines Schlaganfalls“, berichtet Kleinschnitz. Untersuchungen zu späteren Zeitpunkten legen hingegen nahe, dass bestimmte T-Zellen-Populationen, sogenannte regulatorische T-Zellen, antientzündlich wirken und die Gewebsregeneration fördern. „Es gibt also nicht immer gut und schlecht, quasi schablonenartig. Die Auswirkungen dieser Entzündungsreaktion sind wahrscheinlich phasenabhängig“, sagt der Neurologe. Das hängt offenbar damit zusammen, dass die T-Zellen, die später aktiv werden, ganz andere Botenstoffe produzieren als jene, die ganz zu Anfang ins Gehirn einwandern.
Weitere Forschungsergebnisse legen außerdem nahe, dass in den Blutgefäßen zwei Systeme ineinander greifen: Das Gerinnungs- und das Immunsystem. Infolge eines Schlaganfalls lagern sich Blutplättchen an das geschädigte Gewebe im Gehirn an. Gleichzeitig werden lösliche Gerinnungsfaktoren – zunächst Faktor XII – aktiviert. Das setzt die Blutgerinnung in Gang und erhöht das Risiko, dass sich erneut ein Gerinnsel bildet, das das Gefäß verstopft. Das Team um Kleinschnitz hat deshalb in den letzten Jahren vorgeschlagen, den ischämischen Schlaganfall als eine „thrombo-inflammatorische" Erkrankung zu definieren. Die Zusammenhänge sind komplex – und noch längst nicht komplett erforscht, wie Kleinschnitz und seine Kollegen in einem Übersichtsartikel schreiben. Eine wichtige Rolle spielt offenbar das sogenannte Kallikrein-Kinin-System. Diese Kaskade wird ebenfalls durch Faktor XII angestoßen und sorgt im letzten Schritt dafür, dass Bradykinin entsteht. Dieses Peptidhormon setzt weitere Entzündungsprozesse in Gang. „Wenn Bradykinin an seine Rezeptoren bindet, werden proinflammatorische Zytokine ausgeschüttet. Das führt zur Öffnung der Blut-Hirn-Schranke und damit auch zur Ödembildung“, erklärt Friederike Langhauser, Neurowissenschaftlerin in Kleinschnitz‘ Team. Das bedeutet, es wird Wasser ins Gehirn eingelagert.
Indem sie in der akuten Phase verschiedene Komponenten des Kallikrein-Kinin-Systems hemmten, gelang es den Forschern, den Ausgang eines Schlaganfalls bei Mäusen erheblich zu verbessern – und zwar ohne dass die Tiere verstärkt zu Blutungen neigten. Jüngste Versuche legen außerdem nahe, dass ein solcher Eingriff auch noch in einer späteren Phase wirkt: „Mäuse, bei denen wir nach drei Tagen – also nach völliger Ausreifung der Infarkte – das System geblockt haben, zeigten ein besseres Verhalten“, berichtet Langhauser. Die Tiere erholten sich schneller. „Nach vier Wochen haben wir in ihren Gehirnen weniger Immunzellen und in ihren Gefäßen weniger Mikrothromben gefunden als bei der Kontrollgruppe“, ergänzt sie.
In welchem Maße diese Prozesse beim menschlichen Schlaganfall eine Rolle spielen und ob sie auch Gefäße außerhalb des Gehirns betreffen, ist allerdings noch unklar.
Empfohlene Artikel
Immunmodulation – die Therapie der Zukunft
Um einen Schlaganfall zu behandeln, gibt es im Wesentlichen zwei Möglichkeiten. Zum einen die systemische Thrombolyse. Dabei wird dem Patienten über die Venen ein Mittel verabreicht, dass das Blutgerinnsel auflöst. Zum anderen kann man den Thrombus mechanisch entfernen. Aber: „Nur bei etwa 20 Prozent aller Schlaganfallpatienten führen wir überhaupt eine dieser Therapien durch“, sagt Liesz. Dabei nimmt Deutschland in Sachen Schlaganfallbehandlung eine Vorreiterrolle ein. „Die meisten Schlaganfallpatienten weltweit bekommen überhaupt keine spezifische Therapie“. Ein Grund: Gemäß der gültigen Leitlinien muss die systemische Thrombolyse spätestens 4,5 Stunden nach Symptombeginn erfolgen. Somit können nur Patienten behandelt werden, die sich rechtzeitig in einer „Stroke Unit“ einfinden. Außerdem geht die Behandlung mit einem erhöhten Risiko für Hirnblutungen einher. Man müsse daher sehr genau abwägen und etliche Risikofaktoren ausschließen, erklärt Liesz.
In einem sind sich die „Immunostroke“-Forscher einig: „Wir glauben, dass immunologische Mechanismen die Zukunft sind.“ Zum einen sei das Zeitfenster für die Intervention wesentlich länger, begründet Liesz. Zum anderen liegen der Entzündung Mechanismen zu Grunde, die für jeden Schlaganfallpatienten relevant sind. In den letzten Jahren haben Schlaganfallforscher versucht, die Migration von Immunzellen ins Gehirn komplett zu blockieren. Mit dem Medikament Natalizumab, das für die Behandlung von Multipler Sklerose zugelassen ist, fanden sogar zwei klinische Studien statt. Zwar ging es Menschen, denen man nach einem Schlaganfall das Mittel verabreicht hatte, nicht besser als Patienten, die ein Placebo erhalten hatten. „Trotzdem waren die Studien extrem wichtig“, sagt Liesz. Sie zeigten, dass es eines noch tieferen Verständnisses der Entzündungsprozesse bedarf, um sie positiv beeinflussen zu können.
In Zukunft gelte es, gezieltere Ansätze zu verfolgen. „Wir müssen verstehen, welche Zellpopulationen ins Gehirn gehen, dort bleiben und Schaden anrichten“, sagt der Neurologe. Vielleicht kann man diese Zellen dann umpolen, sprich: Sie zu den Immunzellen machen, die man haben möchte. Durch genetische Manipulation oder bestimmte Wirkstoffe könnte man eine T-Zelle, die schädliche Zytokine produziert, vielleicht zu einer machen, die regenerationsfördernde Substanzen herstellt: etwa BDNF, einen Wachstumsfaktor für Nervenzellen oder antiinflammatorische Zytokine wie Interleukin 10 (IL-10) oder TGF-beta. Solche Ansätze sind deutlich komplexer – zumal die Immunreaktion nicht bei jedem Patienten genau gleich abläuft. Genau darin sieht Liesz großes Potenzial. „Wenn wir verstehen, welcher Patient von welcher Art Immuntherapie profitiert, könnte das ein richtiger Game Changer sein.“
Infektionen im Körper
Wenn man sich mit Viren oder Bakterien infiziert hat, ist das Risiko für einen Schlaganfall höher, das legen zahlreiche Studien nahe. Harnwegsinfektionen scheinen besonders gefährlich zu sein: In den Wochen nach der initialen Infektion sei das Risiko für einen Schlaganfall mehr als dreimal so hoch, berichtete ein US-amerikanisches Forscherteam 2019 in der Fachzeitschrift „Stroke“. Es sei aber nicht die Infektion selbst, sondern die damit einhergehende Immunreaktion, die einen Schlaganfall auslösen könne, sagt Arthur Liesz. Eine systemische Entzündung, zum Beispiel ausgelöst durch Viren oder Bakterien, kann das Ablösen einer atherosklerotischen Plaque begünstigen. Wird diese über den Blutkreislauf ins Gehirn geschwemmt, kommt es zu einem Schlaganfall. Numerisch betrachtet spiele dies aber kaum eine Rolle, sagt Liesz: „Nur ein Bruchteil aller Schlaganfälle ist entzündlich bedingt.“
Klinisch relevant ist vielmehr der umgekehrte Weg: Ein Schlaganfall erhöht das Risiko für bakterielle oder virale Infektionen. Denn: Auf eine massive Immunaktivierung folgt eine Immunsuppression. „Innerhalb des ersten Tages kippt das System um“, sagt Liesz. Schlaganfallpatienten verlieren in dieser Zeit bis zu 40 bis 50 Prozent ihrer T- und B-Zellen: „Das Ausmaß der Immunsuppression ist mit AIDS vergleichbar“, sagt der Neurologe. Die Folge: Die Patienten sind extrem anfällig für bakterielle und virale Infektionen. „Die häufigste Todesursache ist nicht der Schlaganfall selbst, sondern die Infektionen“, sagt Liesz. Nicht ohne Grund seien Schlaganfallstationen jene Stationen mit dem höchsten Antibiotikaverbrauch in einem Krankenhaus.
Schlaganfall
Schlaganfall/Apoplexia cerebri/stroke
Bei einem Schlaganfall wird das Gehirn oder Teile davon nicht mehr ausreichend mit Blut versorgt, wodurch Sauerstoff- und Glukoseversorgung beeinträchtigt sind. Die häufigste Ursache ist ein Verschluss einer Arterie (ischämischer Schlaganfall), seltener eine Blutung (hämorrhagischer Schlaganfall). Typische Symptome sind plötzliche Sehstörungen, Schwindel, Lähmungen, Sprach- oder Sensibilitätsstörungen. Langfristige Folgen können verschiedene Gefühls-, Bewegungs- und kognitive Einschränkungen sein.
Zum Weiterlesen
- Stiftung Deutsche Schlaganfall-Hilfe; URL: https://www.schlaganfall-hilfe.de/de/verstehen-vermeiden/was-ist-ein-schlaganfall [Stand 03.02.2021]
- Forschungsgruppe Immunostroke; URL: https://immunostroke.de/ [Stand 03.02.2021]
- De Meyer SF, Denorme F, et al. Thromboinflammation in Stroke Brain Damage. Stroke. 2016 Apr;47(4):1165-72. doi: 10.1161/STROKEAHA.115.011238. Epub 2016 Jan 19. PMID: 26786115. URL: https://www.ahajournals.org/doi/full/10.1161/STROKEAHA.115.011238