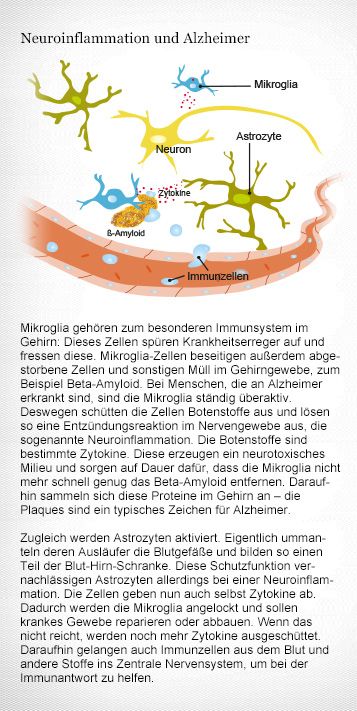
Ein Immunsystem nur fürs Gehirn

Das normale Immunsystem würde im Gehirn mehr schaden als schützen. Dort gibt es eigene Mechanismen der Krankheitsabwehr, vor allem die Neuroinflammation. Diese funktioniert aber bei Krankheiten wie Multipler Sklerose und Schlaganfall nicht richtig.
Wissenschaftliche Betreuung: Prof. Dr. Ingo Bechmann
Veröffentlicht: 26.01.2014
Niveau: schwer
- Das Nervengewebe im Gehirn ist besonders geschützt durch die Blut-Hirn-Schranke. Diese hält Krankheitserreger fern und verhindert, dass Immunzellen und Antikörper in das Nervengewebe des Gehirns eindringen können und die neuronalen Netze zerstören.
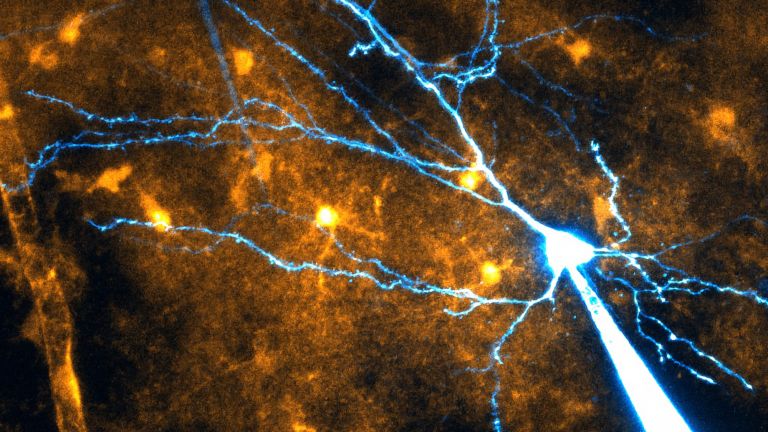
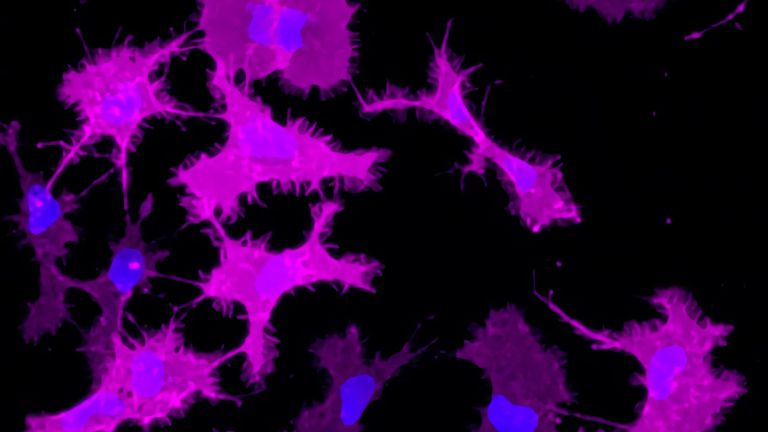
- Im Gehirn gibt es Immunzellen, aber nicht solche, die im Blut sind und im Rest des Körpers wirken. Die Hirn-Immunzellen sind die Mikroglia. Sie beseitigen Zellmüll und Keime im Nervengewebe.
- Eine Entzündung des Nervengewebes heißt Neuroinflammation. Das ist eine gesunde Reaktion des Immunsystems, mit der das Gehirn vor Infektionen geschützt wird. Bei der Neuroinflammation überwinden Immunzellen des Blutes die Blut-Hirn-Schranke.
- Eine Neuroinflammation kann aber auch Krankheiten wie Multiple Sklerose auslösen. Dabei entsteht ein komplexes und zerstörerisches Zusammenspiel aus Mikroglia und Immunzellen, die aus dem Blut ins Gehirn wandern.
- Bei einem Schlaganfall sterben nicht nur Hirnzellen ab, auch die Blut-Hirn-Schranke wird vorübergehend in Mitleidenschaft gezogen. Dadurch gelangen unkontrolliert
Blut-Hirn-Schranke
Blut-Hirn-Schranke/-/blood brain barrier
Eine selektiv durchlässige Membran, die von den Zellen in den Wänden der kapillaren Blutgefäße im Gehirn gebildet wird. Sie verhindert das Eindringen von Schadstoffen über das Blut, erlaubt jedoch den Übergang von Nährstoffen aus dem Blut ins Gehirn.
Mikroglia
Mikroglia/-/microglia
Der kleinste Typ der Gliazellen ist Teil des zellulären Immunsystems und unter anderem zuständig für die Entfernung abgestorbener Neurone. Mikroglia können sich amöbenartig fortbewegen.
Multiple Sklerose
Multiple Sklerose/Encephalomyelitis disseminata/multiple sclerosis
Eine häufige neurologische Krankheit, die vorwiegend im jungen Erwachsenenalter auftritt. Aus noch ungeklärtem Grund greifen körpereigene Zellen die Myelinscheiden der Nervenzellen an und zerstören diese. Das kann im gesamten zentralen Nervensystem geschehen, weshalb zwei verschiedene Multiple-Sklerose-Patienten an ganz unterschiedlichen Symptomen leiden können. Besonders häufig sind Sehstörungen und Taubheitsgefühle in den Gliedmaßen.
Schlaganfall
Schlaganfall/Apoplexia cerebri/stroke
Bei einem Schlaganfall werden das Gehirn oder Teile davon zeitweilig nicht mehr richtig mit Blut versorgt. Dadurch kommt es zu einer Unterversorgung mit Sauerstoff und dem Energieträger Glukose. Häufigster Auslöser des Schlafanfalls ist eine Verengung der Arterien. Zu den häufigsten Symptomen zählen plötzliche Sehstörungen, Schwindel sowie Lähmungserscheinungen. Als Langzeitfolgen können verschiedene Arten von Gefühls– und Bewegungsstörungen auftreten. In Deutschland ging 2006 jeder dritte Todesfall auf einen Schlaganfall zurück.
Mikroglia
Mikroglia/-/microglia
Der kleinste Typ der Gliazellen ist Teil des zellulären Immunsystems und unter anderem zuständig für die Entfernung abgestorbener Neurone. Mikroglia können sich amöbenartig fortbewegen.
Neurodegeneration
Neurodegeneration/-/neurodegeneration
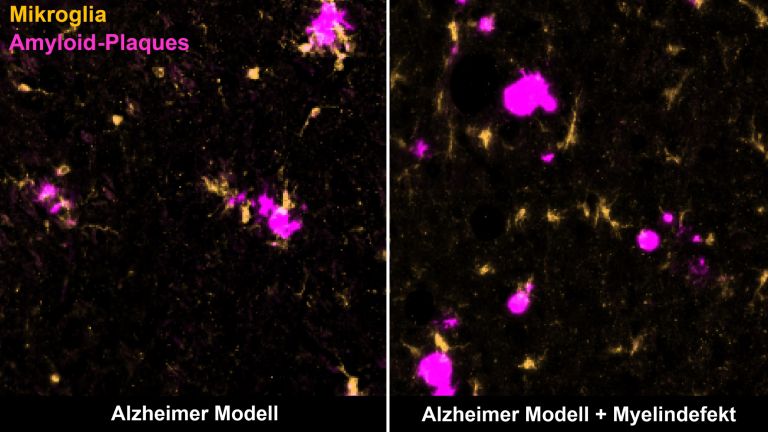
Sammelbegriff für Krankheiten, in deren Verlauf Nervenzellen sukzessive ihre Struktur oder Funktion verlieren, bis sie teilweise sogar daran zugrunde gehen. Vielfach sind falsch gefaltete Proteine der Auslöser – wie etwa bestimmte Formen der Eiweiße Beta-Amyloid und Tau im Falle von Alzheimer. Bei anderen Krankheiten, beispielsweise bei Parkinson oder Chorea Huntington, werden Proteine innerhalb der Neurone nicht richtig abgebaut. In der Folge lagern sich dort toxische Aggregate ab, was zu den jeweiligen Krankheitserscheinungen führt. Während Chorea Huntington eindeutig genetisch bedingt ist, scheint es bei Parkinson und Alzheimer allenfalls bestimmte Ausprägungsformen von Genen zu geben, welche ihre Entstehung begünstigen. Keine dieser neurodegenerativen Erkrankungen kann bisher geheilt werden.
Neuron
Neuron/-/neuron
Das Neuron ist eine Zelle des Körpers, die auf Signalübertragung spezialisiert ist. Sie wird charakterisiert durch den Empfang und die Weiterleitung elektrischer oder chemischer Signale.
Gen
Gen/-/gene
Informationseinheit auf der DNA. Den Kernbestandteil eines Gens übersetzen darauf spezialisierte Enzyme in so genannte Ribonukleinsäure (RNA). Während manche Ribonukleinsäuren selbst wichtige Funktionen in der Zelle ausführen, geben andere die Reihenfolge vor, in der die Zelle einzelne Aminosäuren zu einem bestimmten Protein zusammenbauen soll. Das Gen liefert also den Code für dieses Protein. Zusätzlich gehören zu einem Gen noch regulatorische Elemente auf der DNA, die sicherstellen, dass das Gen genau dann abgelesen wird, wenn die Zelle oder der Organismus dessen Produkt auch wirklich benötigen.
Plaques
senile Plaques/-/senile plaques
Senile Plaques lagern sich in der grauen Hirnsubstanz ab, wenn ein Eiweiß – das so genannte Amyloid-Vorläuferprotein – nicht korrekt abgebaut wird. Entzündungen sowie Erkrankungen des Fett– oder des Zuckerstoffwechsels können die Plaquebildung begünstigen. Im Schnitt erreichen die Ablagerungen einen Durchmesser von 50 Mikrometern. Das Auftreten von Plaques ist eine von mehreren anatomischen Veränderungen im Gehirn, anhand derer Pathologen nach dem Tod eine Alzheimer-Erkrankung diagnostizieren können.
Der Autofahrer hat auf der Autobahn einen Schlaganfall. Ein schwerer Autounfall. Eine Glasscherbe aus dem Seitenfenster schneidet tief in den Arm. Tage später entzündet sich die Wunde dieses fiktiven Beispiels: Die Haut schwillt an, die Stelle wird rot und heiß, die Wunde fängt an zu pochen und zu schmerzen. Mediziner nennen das eine klassische Inflammation, also eine Entzündungsreaktion. Ausgelöst wird solch eine Entzündung, wenn sich in der Wunde zum Beispiel Bakterien ausbreiten. Zellen des Immunsystems erkennen die Eindringlinge und schlagen über Botenstoffe Alarm. Das lockt sofort weitere Immunzellen an. Diese verlassen die Blutgefäße und dringen in das angegriffene Gewebe ein. Dort schlagen die Immunzellen richtig zu: Die Bakterien in der Wunde werden gefressen. Die Immunzellen sind in Entzündungsherden aber so aggressiv, dass sie auch körpereigene Zellen, etwa Haut– oder Bindegewebszellen, zerstören. So wird fast immer auch Gewebe geschädigt, das eigentlich gesund war. Doch das ist egal – es kann ja ersetzt werden. Viel wichtiger ist es, dass das Immunsystem auch wirklich jeden Keim eliminiert.
Im Gehirn allerdings wäre diese Strategie fatal. „Was einmal weg ist im Gehirn, ist für immer weg“, sagt Wolfgang Brück, Neuropathologe an der Universität Göttingen. Der Grund: Nervenzellen wachsen nicht nach. Zudem sind in den neuronalen Netzwerken ja auch Informationen gespeichert, etwa Erinnerungen oder Verhaltensweisen. Wenn hier das Immunsystem derart rigoros reagieren würde wie bei einer entzündeten Schnittwunde am Arm, dann ginge mehr verloren als ein paar Nervenzellen.
„Weil die Regeneration fehlt, ist das Gehirn besonders geschützt“, erläutert Wolfgang Brück. Das Hirn ist so verbarrikadiert, dass möglichst weder Krankheitserreger noch Zellen und Antikörper des Immunsystems ins Hirn eindringen können. Beides wird durch eine anatomische Besonderheit gewährleistet: die Blut-Hirn-Schranke. Im übrigen Gewebe haben die kleinsten Äderchen, die so genannten Kapillaren, undichte Stellen. Durch diese winzigen Lücken können bestimmte Antikörper aus dem Blut in die Umgebung gelangen. Richtige Immunzellen, wie zum Beispiel Neutrophile, passen hier zwar nicht durch, aber sie gelangen über kleine besondere Gefäße in das umliegende Gewebe. Wie solche Zellen in Ausnahmesituationen ins Gehirn gelangen, das ist noch nicht eindeutig geklärt. Für die Antikörper weiß man aber: Im Gehirn haben die Blutgefäße keine solchen undichten Stellen. Die Gefäßwände dort bestehen aus Zellen, die sehr fest miteinander verbunden sind, und zwar über so genannte tight junctions. Zur Sicherheit sind die Äderchen auch noch von einer zweiten Schicht ummantelt. Die wird gebildet von Ausläufern spezialisierter Nervenzellen im zentralen Nervensystem: den Astrozyten. Die Blut-Hirn-Schranke besteht also genau genommen aus zwei Grenzzäunen: einer verstärkten Kapillarwand und einer Astrozytenschicht.
Neuron
Neuron/-/neuron
Das Neuron ist eine Zelle des Körpers, die auf Signalübertragung spezialisiert ist. Sie wird charakterisiert durch den Empfang und die Weiterleitung elektrischer oder chemischer Signale.
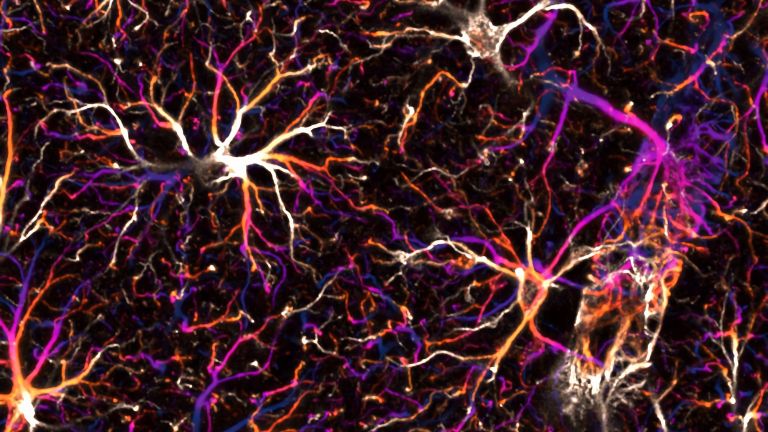
Astrozyt
Astrozyt/-/astrocyte, astroglia
Astrozyten sind die größten unter den Gliazellen. Zu ihren Aufgaben gehören z.B. die Immunabwehr (auch Blut-Hirn-Schranke) oder die Wiederaufnahme ausgeschütteter Neurotransmitter (Botenstoffen im Gehirn).
Das Gehirn braucht ein Immunsystem
Diese doppelte Grenzziehung funktioniert gegen Viren und Bakterien ziemlich gut. „Nur ganz wenige Krankheitserreger können die Blut-Hirn-Schranke überwinden“, sagt Wolfgang Brück. Den gesamten Körper kann eine Vielzahl verschiedener Keime befallen – doch nur ein Bruchteil von ihnen hat die Fähigkeit, ins Gehirn einzudringen. Aber die sind gefährlich. So können Bakterien wie Meningokokken und Streptokokken eine Hirnhautentzündung auslösen. Deshalb kommt das Gehirn nicht komplett ohne Immunsystem aus.
Tatsächlich gibt es im Gehirngewebe Zellen, die darauf spezialisiert sind, Krankheitserreger aufzuspüren und abzutöten: die Mikroglia. Sie arbeiten zuverlässig und fressen gefährliche Keime weg.
Doch bei größeren Angriffen, etwa wenn gleichzeitig viele Meningokokken die Blut-Hirn-Schranke überwinden, sind die Mikroglia machtlos. Wenn diese Zellen das Gehirngewebe in Gefahr sehen, dann reagieren sie ähnlich wie die Immunzellen in der Haut zum Beginn einer Entzündung: Sie schlagen Alarm, indem sie Botenstoffe aussenden. Dadurch wird der doppelte Grenzzaun der Blut-Hirn-Schranke nun doch ein wenig durchlässig: Ausgewählte Zellen des Immunsystem, etwa T-Zellen und Neutrophile, dürfen passieren – sie drängen sich durch die tight junctions hindurch und gelangen ins Hirngewebe. Eine Entzündungsreaktion beginnt. Ihr fehlen allerdings klassische Merkmale der Inflammation: Es gibt weder Schwellung, Rötung, Schmerz noch ist dort die Temperatur erhöht. Die Mediziner sprechen von einer Neuroinflammation, einer Entzündung des zentralen Nervensystems. Das ist eine gesunde Reaktion des Körpers, um zu verhindern, dass das Gehirn krank wird. Doch das, was eigentlich heilen soll, kann in Ausnahmefällen zur Gefahr fürs Gehirn werden. Die Neuroinflammation ist nämlich beteiligt an der Entstehung mehrerer schwerer Krankheiten des zentralen Nervengewebes.
Mikroglia
Mikroglia/-/microglia
Der kleinste Typ der Gliazellen ist Teil des zellulären Immunsystems und unter anderem zuständig für die Entfernung abgestorbener Neurone. Mikroglia können sich amöbenartig fortbewegen.
Empfohlene Artikel
Multiple Sklerose kann bei einem gestörten Immunsystem entstehen
Bei der Neuroinflammation ist ein hoch reguliertes Zusammenspiel von Mikroglia, Blut-Hirn-Schranke und den Immunzellen des Blutes wichtig. Wie wichtig, das zeigt sich, wenn es durcheinander gerät: Dann entstehen Krankheiten wie Multiple Sklerose (MS).
Wolfgang Brück erforscht dieses Leiden, bei dem das Mark von Nervenfasern zerstört wird und Betroffene unter anderem Lähmungserscheinungen und Sehstörungen bekommen. Der Wissenschaftler berichtete 2008 zusammen mit Kollegen in der Fachzeitschrift “Current Opinion in Neurology”: Immunologisch betrachtet hat die Krankheit MS zwei Phasen. In der ersten Phase kommen die Verschlechterungen schubweise. Dafür sind vor allem Immunzellen aus dem Blut verantwortlich. Etwa so genannte T-Helferzellen, die über einen bisher nicht komplett verstandenen Mechanismus erst an den Wänden der Hirn-Äderchen hängen bleiben und dann durch die Blut-Hirn-Schranke hindurchkriechen. Im neuronalen Gewebe aktivieren die T-Helferzellen die Mikroglia–Zellen. Diese beginnen daraufhin, die Isolationsschicht der Fortsätze von Nervenzellen anzugreifen, diese so genannten Myelinscheiden werden zerstört. „Für diese erste Phase der MS haben wir einige Medikamente, die alle ähnlich wirken: Sie dichten die Blut-Hirn-Schranke ab“, sagt Wolfgang Brück. So kann das zerstörerische Werk der Immunzellen eingedämmt und das Fortschreiten der Multiplen Sklerose hinausgezögert werden. Doch in der zweiten Phase, die in der Regel Jahre später einsetzt, wirken die Medikamente nicht mehr. Auch kommen die Verschlimmerungen nicht mehr in Schüben, sondern eher kontinuierlich. „Wir haben herausgefunden, dass in dieser Phase kaum noch T-Helferzellen neu ins Gehirn einwandern“, sagt Wolfgang Brück. „Die Mikroglia sind dann von sich aus aktiv; sie brauchen die T-Zellen offenbar nicht mehr.“ Außerdem werden sie bei ihrer Zerstörung wahllos: Beschränkten sie sich bis dahin wesentlich auf die Myelinscheiden, so greifen sie nun alles an. „Das ist das Tückische an der späten MS-Phase: Auch die Oligodendrozyten werden zerstört, also die Zellen, aus deren Fortsätzen die Myelinscheiden bestehen“, sagt Wolfgang Brück. „So können dann die Myelinscheiden nicht mehr nachgebildet werden.“
Multiple Sklerose
Multiple Sklerose/Encephalomyelitis disseminata/multiple sclerosis
Eine häufige neurologische Krankheit, die vorwiegend im jungen Erwachsenenalter auftritt. Aus noch ungeklärtem Grund greifen körpereigene Zellen die Myelinscheiden der Nervenzellen an und zerstören diese. Das kann im gesamten zentralen Nervensystem geschehen, weshalb zwei verschiedene Multiple-Sklerose-Patienten an ganz unterschiedlichen Symptomen leiden können. Besonders häufig sind Sehstörungen und Taubheitsgefühle in den Gliedmaßen.
Neuron
Neuron/-/neuron
Das Neuron ist eine Zelle des Körpers, die auf Signalübertragung spezialisiert ist. Sie wird charakterisiert durch den Empfang und die Weiterleitung elektrischer oder chemischer Signale.
Multiple Sklerose
Multiple Sklerose/Encephalomyelitis disseminata/multiple sclerosis
Eine häufige neurologische Krankheit, die vorwiegend im jungen Erwachsenenalter auftritt. Aus noch ungeklärtem Grund greifen körpereigene Zellen die Myelinscheiden der Nervenzellen an und zerstören diese. Das kann im gesamten zentralen Nervensystem geschehen, weshalb zwei verschiedene Multiple-Sklerose-Patienten an ganz unterschiedlichen Symptomen leiden können. Besonders häufig sind Sehstörungen und Taubheitsgefühle in den Gliedmaßen.
Mikroglia
Mikroglia/-/microglia
Der kleinste Typ der Gliazellen ist Teil des zellulären Immunsystems und unter anderem zuständig für die Entfernung abgestorbener Neurone. Mikroglia können sich amöbenartig fortbewegen.
Oligodendrozyten
Oligodendrozyten/-/oligodendrocytes
Zellen des Zentralen Nervensystems, die die Myelinscheide um die Nervenzellen bilden und so deren Leitungsgeschwindigkeit erhöhen. Sie gehören zu den Gliazellen.
Die zweite Gefahr bei einem Schlaganfall
Zurück zu dem fiktiven Autofahrer, der wegen eines Schlaganfalls einen Unfall verursacht hat. Auch bei ihm zeigt sich, wie wichtig die Blut-Hirn-Schranke und ein gesundes Immunsystem des Gehirns sind. Ein Schlaganfall entsteht, wenn sich eine Ader im Gehirn verschließt und Nervengewebe nicht mehr durchblutet wird. Dann können ganze Bereiche des Hirngewebes absterben; sie sind unwiederbringlich verloren. Doch um diese abgestorbenen Bereiche herum gibt es noch sehr viel größere Areale, die nach dem Schlaganfall bedroht sind – und die Gefahr kommt vom Immunsystem. Denn die mangelnde Blutversorgung hat nicht nur Hirnzellen sterben lassen, sondern auch die Blut-Hirn-Schranke ist in Mitleidenschaft gezogen worden. Deshalb können die Immunzellen aus dem Blut ungehindert in das Nervengewebe eindringen. Dort greifen die Immunzellen Hirnzellen an und zerstören sie.
Die Neuroinflammation schützt also das Nervengewebe im Gehirn vor Krankheitserregern. Gerät diese Immunreaktion aber außer Kontrolle, dann treibt sie Krankheiten wie Multiple Sklerose, Schlaganfall und möglicherweise auch Alzheimer (siehe Kasten) voran. Deshalb ist es das Ziel der Forschung, die Prozesse bei der Neuroinflammation noch besser zu verstehen und damit neue Therapieansätze für diese Leiden zu finden.
Schlaganfall
Schlaganfall/Apoplexia cerebri/stroke
Bei einem Schlaganfall werden das Gehirn oder Teile davon zeitweilig nicht mehr richtig mit Blut versorgt. Dadurch kommt es zu einer Unterversorgung mit Sauerstoff und dem Energieträger Glukose. Häufigster Auslöser des Schlafanfalls ist eine Verengung der Arterien. Zu den häufigsten Symptomen zählen plötzliche Sehstörungen, Schwindel sowie Lähmungserscheinungen. Als Langzeitfolgen können verschiedene Arten von Gefühls– und Bewegungsstörungen auftreten. In Deutschland ging 2006 jeder dritte Todesfall auf einen Schlaganfall zurück.
Schlaganfall
Schlaganfall/Apoplexia cerebri/stroke
Bei einem Schlaganfall werden das Gehirn oder Teile davon zeitweilig nicht mehr richtig mit Blut versorgt. Dadurch kommt es zu einer Unterversorgung mit Sauerstoff und dem Energieträger Glukose. Häufigster Auslöser des Schlafanfalls ist eine Verengung der Arterien. Zu den häufigsten Symptomen zählen plötzliche Sehstörungen, Schwindel sowie Lähmungserscheinungen. Als Langzeitfolgen können verschiedene Arten von Gefühls– und Bewegungsstörungen auftreten. In Deutschland ging 2006 jeder dritte Todesfall auf einen Schlaganfall zurück.
zum Weiterlesen:
- Aguzzi, A. et al.: Microglia: Scapegoat, Saboteur, or Something Else? In: Science, 339 (6116) S. 156 – 161, 2013. (Link zum Abstract)
- Singh, S. et al.: Microglial nodules in early multiple sclerosis white matter are associated with degenerating axons. In: Acta Neuropathologica. 125, S. 595 – 608, 2013. (Link zum Volltext)
- Website des Sonderforschungsbereichs TRR 43 zum Theme Neuroinflammation
![Blut-Hirn-Schranke: Doppelte Barriere zwischen Blutkreislauf und Zentralem Nervensystem. Grafikerin: Meike Ufer [nach Armin Kübelbeck/wikipedia.de ].](https://www.dasgehirn.info/sites/default/files/styles/scale_768_w/public/images/copy_of_Blut_Hirn_Schranke_Ansicht_schmal.jpg?itok=jJ2gXuYc)