Zugereiste Kraftwerke

Archaisch, mächtig, flexibel: Mitochondrien sind weit mehr als Kraftwerke. Sie treiben die Evolution, bestimmen, was das Gehirn leistet und sind mitverantwortlich, wenn wir bei Sauerstoffmangel in Ohnmacht fallen.
Wissenschaftliche Betreuung: Prof. Dr. Thomas Misgeld
Veröffentlicht: 15.03.2023
Niveau: leicht
- Vor mehr als einer Milliarde Jahren gelangten Bakterien in andere Einzeller. Ihre evolutionären Nachfahren finden wir heute als Mitochondrien in weitestgehend allen Eurkaryoten, also Lebensformen mit Zellkern.
- Die Vererbung von Kern- und mitochondrialer DNA geschieht in enger Abstimmung.
- Die Mitochondriengene mutieren sehr rasch und können so auch neue Arten begründen.
- Wenn die Mitochondrien nicht zum Zellkern passen, sind die Nachkommen zunächst lebensfähig, aber vermindert furchtbar. Sie drohen auszusterben.
- Mitochondrien bilden im Gehirn mobile Kraftwerke, die fusionieren und sich aufteilen können.
- Für alle höheren kognitiven Leistungen ist die volle Leistung der Mitochondrien nötig.
Medizinische Eingriffe an den Mitochondrien gibt es bereits – und zwar in der Reproduktionsmedizin im Ausland. So etwa in Großbritannien: Wenn die Mutter ein mitochondriales Erbleiden hat, lässt sich durch den Austausch der Mitochondrien gegen die einer gesunden Spenderin verhindern, dass die Krankheit weitergegeben wird. Es gibt mehr als 400 mitochondriale Erbleiden, die allesamt selten sind. Einige führen zum Erblinden, andere zu Epilepsie und Muskelschwäche.
Daneben wird der Austausch der Mitochondrien aber auch in bestimmten Kliniken in Griechenland, Spanien und der Ukraine genutzt, um unfruchtbaren Paaren zu einem leiblichen Kind zu verhelfen: Besonders ältere Paare sind häufig von Unfruchtbarkeit betroffen, denn Mitochondrien verlieren mit dem Altern auf natürliche Weise nach und nach ihre Fähigkeiten. Sie stellen weniger Energie bereit und in ihrem Erbgut häufen sich Schäden an. Der Austausch der Mitochondrien in der Eizelle ist eine neue Technik, die Keimzellen zu verjüngen und quasi mit frischen Energiekraftwerken auszustatten. Ob via Mitochondrienersatztherapie, „MRT“, geborene Kinder langfristig gesund sind, ist allerdings völlig offen. Forschungen zeigen, dass die Vererbung von Kern-DNA und mitochondrialer DNA sich in enger Abstimmung vollziehen muss, sonst leidet die Fitness der Nachkommen.
Derzeit verdichten sich immer mehr Hinweise, dass die Mitochondrien bei vielen neurodegenerativen Erkrankungen in Mitleidenschaft gezogen sind. Das ist bei der Parkinsonschen Krankheit gut belegt, genauso bei der Alzheimerschen und anderen Demenzen, bei Amyotropher Lateralsklerose und Chorea Huntington. Aber auch bei chronischer Fatigue und Long Covid wird eine massive Schädigung der mitochondrialen Energieversorgung beobachtet. Bis heute allerdings ist die Frage danach, was Ursache und was die Folge ist, unbeantwortet.
Wie komplex die Zusammenhänge sind, verdeutlichen die neuesten Arbeiten des Mitochondrienforschers Eric Schon vom Columbia University Medical Center. Seinen Erkenntnissen zufolge läuft bei einer Demenz zuerst die Kommunikation zwischen Mitochondrien und dem Rest der Zelle aus dem Ruder. Die Membran, die die Mitochondrien umhüllt, sei bei Demenzpatienten zehn Mal länger als bei Gesunden. Aufgrund von Enzymen in dieser Membran entstehen dann auch vermehrt Eiweißablagerungen aus Amyloid, die für die Alzheimer-Erkrankung charakteristisch sind.
„Die Mitochondrienmembran besteht aus Fetten, allen voran Cholesterin. Wenn zu viel Cholesterin aus der Nahrung in die Nervenzellen gelangt, entsteht in Zellkulturversuchen und Tierexperimenten eine XXL-Mitochondrienmembran“, sagt Schon. Seine Schlussfolgerung: Wer Demenzen behandeln will, muss die Mitochondrien ins Visier nehmen und die Ernährung lebenslang ändern. Gesättigte Fettsäuren und Transfette in der modernen westlichen Kost sind es vor allem, die zu viel Cholesterin in den Körper bringen. Und immerhin ist ja für mediterrane Kost mit gesunden Ölen auch belegt, dass sie vor einer späteren Demenz schützt und bei bestehender Demenz günstig ist.
Mitochondrien sind überlebenswichtig. Doch sie können auch zum Feind werden und gefährliche chronische Entzündungen auslösen. Das passiert, wenn das Immunsystem, unter Stress gerät, genauer gesagt, die Monozyten. Diese Unterform der weißen Blutkörperche n wandert aus dem Blut in das Gewebe und verwandelt sich dort in Fresszellen (Makrophagen), die Bakterien, Zelltrümmer und veränderte Eiweiße aufnehmen und entsorgen können. Allerdings kann eine ungesunde Lebensweise, etwa Rauchen, Stress, Bewegungsmangel) dazu führen, dass ein Übermaß an zellulärem Abfall entsteht, der die Fresszellen überfordert.
Christoph Binder vom Klinischen Institut für Labormedizin der MedUni Wien und des CeMM hat gemeinsam mit seinen Kollegen untersucht, was im Stressfall passiert. Sie haben erkannt, dass die Monozyten Teile ihrer Zellmembran in Form von sogenannten Mikrovesikeln abschnüren. Diese Mikrovesikel können Alarmsignale zu anderen Zellen versenden.
Wie die Forschenden entdeckt haben, erhält ein Teil dieser Mikrovesikel Mitochondrien. Diese freigesetzten Mitochondrien haben ein enormes Potential im Körper, Signalwege anzukurbeln, die letztlich zu chronischen Entzündungsprozessen führen können. Chronische Entzündungen gelten als mitverantwortlich für das Entstehen von Krankheiten wie Herzkreislauferkrankungen, Diabetes, Krebs, Depressionen und Alzheimer.
Die folgenreiche Vereinnahmung hat sich vor mindestens einer Milliarde Jahren ereignet. Lange bevor Tiere und Menschen die Erde bevölkerten. Im Wasser, das den Planeten bedeckte, trafen ein Bakterium und ein weiterer Einzeller aufeinander. Der Einzeller verleibte sich das Bakterium ein – eine Fusion zweier Lebensformen, die letztlich für beide von Nutzen war: So entstanden die Organelle, die sich heute in jeder Zelle von Tieren, Pflanzen und Menschen befinden.
Relikt der geschichtsträchtigen Verschmelzung, die als Endosymbiontentheorie in die Lehrbücher einging, sind beispielsweise die Mitochondrien, gern als „Kraftwerke der Zelle“ bezeichnet. Ihre Erbinformation ist bis heute „nackt“ und ringförmig als sogenanntes Plasmid angeordnet – so wie man es von Bakterien kennt. Dagegen ist die DNA des Zellkerns auf Histone aufgerollt, spezielle Proteine, die die DNA verpacken. Zudem sind die Mitochondrien von einer Doppelmembran umhüllt, die entfernt an die Zellwand von Bakterien erinnert. Auch, dass die mitochondriale DNA viel schneller Mutationen anhäuft – wohl weil die Reparatursysteme weniger effizient arbeiten – könnte auf Bakterien zurückgehen, die aufgrund ihrer kurzen Lebensdauer auf derartige Mechanismen weniger angewiesen sind. Die Kern-DNA ist dagegen robuster gegenüber dem Zahn der Zeit.
Die Macht der Mitochondriengene
Gleichwohl wurde der Beitrag der Mitochondrien zur Erbmasse lange vernachlässigt, weil ihre Gene nur einen Anteil von 0,1 Prozent beisteuern. Sie zählen gar nur 37 Gene, gegenüber rund 25.500 auf der Doppelhelix im Zellkern. Die Mitochondrien stammen in der Regel von der Mutter. Die Kraftwerke des Vaters werden in der befruchteten Eizelle eliminiert. Es gibt allerdings Ausnahmen „Toyota-Prinzip: Nichts ist unmöglich“, kommentiert die Neurowissenschaftlerin Petra Wahle von der Universität Bochum. „Dann gibt der Vater seine Mitochondrien weiter. Das ist aber selten.“
So oder so – lange dachten Forscher, dass die Vererbungswege für die Mitochondrien-DNA und die Kern-DNA unabhängig nebeneinander existieren. Doch neuere Studien unterstreichen, wie eng Zellkern und Mitochondrien sich aufeinander abstimmen und miteinander austauschen.
Der Genetikspezialist Wei Wei von der Universität Cambridge und seine Kollegen untersuchten dafür das Erbgut von 1.526 Müttern und ihren Kindern. Und zwar sequenzierten sie sowohl das Kern- als auch das mitochondriale Genom. Dabei fiel ihnen auf, dass Mutationen im Mitochondriengenom nicht beliebig an den Nachwuchs weitergegeben werden. Vielmehr setzten sich eher solche Varianten durch, die bereits in der Vergangenheit aufgetreten waren und die mit der Kern-DNA harmonierten. Dies ergab ein Abgleich mit einer Gendatenbank, in der die Geninformationen zu 40.325 weiteren Personen hinterlegt waren. Wei schließt daraus, dass die Kern-DNA kontrolliert, welche Mitochondrien-Erbinformationen sich durchsetzen. Beide Vererbungswege sind keineswegs isoliert voneinander.
„Mitochondrien ko-evolvieren mit der Kern-DNA“, sagt Wahle. Das habe damit zu tun, dass sie längst nicht nur Energielieferanten sind. Sie haben vielfältige basale Funktionen. So steuern sie beispielsweise die Produktion wichtiger Signalstoffe und Zellbausteine. Nur mit ihrer Hilfe kann die Zelle komplexen Proteine und andere Stoffe erzeugen. Diese Baustoffe brauchen wiederum die Mitochondrien dauernd, um sich permanent rundzuerneuern. Es besteht eine wechselseitige Abhängigkeit. Diese bedingt, dass die Erbmasse von Mitochondrien und Kern fein aufeinander abgestimmt sein muss.
Wenn die Mitochondriengene nicht passen, droht das Aussterben
Das geht so weit, dass beliebig mutierte Mitochondrien die Fitness des Organismus kompromittieren würden. Wenn Forschende etwa die Mitochondrien einer anderen Art in die Keimbahn einschleusen, sind die Nachkommen dieser Bastarde zwar lebensfähig, aber weniger fruchtbar, legt Wahle dar. „Sie entwickeln sich schlechter und sterben unter dem Strich wieder aus.“
Mitochondriengene weisen aber, wie erwähnt, enorm hohe Mutationsraten auf. Auf diese Weise helfen sie Lebewesen dabei, sich zu Lebzeiten an sich rasch verändernde Umweltbedingungen anzupassen. Sie modulieren beispielsweise die Menge bereitgestellter Energie.
Über Mitochondrienmutationen entstehen auch in kurzer Zeit neue Arten, wie der israelische Evolutionsforscher Dan Mishmar herausarbeitete: etwa, wenn sich die Lebensräume zweier Populationen trennen. Dann verändert sich deren mitochondriale DNA derart rasch, dass beide schon nach kurzer Zeit nicht mehr kompatibel miteinander sind. Sie können zusammen keine ausreichend lebensfähigen Nachkommen mehr zeugen.
Mehr als kleine Punkte im Neuron
Neben der Fruchtbarkeit sind es kognitive Fähigkeiten, die als Erstes leiden, wenn die Mitochondrien schwächeln. Nach derzeitigem Wissensstand stehen alle neurodegenerativen Krankheiten mit maroden Zellkraftwerken in Verbindung (siehe Kasten). Die Nervenzellen im Gehirn, aber auch die Zellen von Muskeln und Auge haben einen besonders hohen Energiebedarf.
Das liegt an zwei Besonderheiten. Damit kognitive Prozesse, das Denken und Handeln, ablaufen können, muss der Ionenhaushalt im Gehirn in einem Gleichgewicht sein. Vor allem der Calciumspiegel darf weder in den Zellen noch außerhalb zu sehr abfallen. Das entscheidet mitunter über Leben und Tod einer Zelle. Und, wenn Nervenzellen feuern, müssen sie Aktionspotentiale weiterleiten. Auch das kostet viel Energie.
„In Lehrbüchern sind Mitochondrien immer so diskret hingezeichnet. Aber wir haben pro Neuron mehrere hundert von diesen Mitochondrien“, sagt der Neurowissenschaftler Oliver Kann von der Medizinischen Fakultät der Universität Heidelberg. Das sind viel mehr als beispielsweise in weniger energiehungrigen Geweben wie die Haut.
Mit Blick auf die Mitochondrien sei Neuron allerdings nicht gleich Neuron, wie Kann betont. In seinen Forschungen ergründet er, wie sich verschiedene Hirnzelltypen in ihren Mitochondrien unterscheiden. Manches ist augenfällig, etwa wenn seine Mitarbeitenden die Mitochondrien in Hirnschnitten von Ratte oder Maus histologisch anfärben. In den Dendriten, den verästelten Zellfortsätzen, die die elektrische Erregung von Nachbarzellen aufnehmen, sehen Mitochondrien langgezogen aus. Wenn man aber entlang des Zellfortsatzes näher an die Zelle heranrückt, werden die Mitochondrien kompakt und punktförmig. Und auch in den Prinzipalneuronen selbst, zu denen etwa die Pyramidenzelle gehört, haben sie diese aus Lehrbüchern vertraute Form.
Empfohlene Artikel
Mitochondrien sind mobil und teilbar wie ein Güterzugsystem
Besonders viele Mitochondrien sitzen in der synaptischen Endigung, also an jenem Ort, an dem Information von einer Nervenzelle zur nächsten übertragen wird. Dort ist besonders viel Energie nötig, um das Signal über den synaptischen Spalt weiterzuleiten. Dafür schließen sich die Mitochondrien teilweise sogar lokal zusammen. Sie bilden hochdynamische Netzwerke, erklärt Kahn, ähnlich einem Güterverkehrssystem. Mitochondrien können sich tatsächlich auch fortbewegen. Sie wandern entlang des Axons und nutzen dafür Mikrotubuli, röhrenförmige Proteine, und molekulare Motoren.
Qua ihrer Mobilität können sich Mitochondrien sammeln. Noch dazu sind sie – wieder in Analogie zum Güterzugsystem in der Lage - miteinander zu verschmelzen, sodass aus mehreren Mitochondrien ein Mitochondrium wird, oder sich zu teilen. Diese Eigenart wird als „fusion“ für Verschmelzung und „fission“ für Spaltung bezeichnet. Wie wichtig sie ist, zeigt auch die Entdeckung, dass eine Stammzelle sich genau dann zum Neuron entwickelt, wenn sich die Mitochondrien in ihr massiv teilen und damit in ihrer Zahl erhöhen.
Wenn Mitochondrien nicht abliefern, schwächeln wir beim Lernen und Autofahren
Besonders viele Mitochondrien benötigen aber auch bestimmte Nervenzellen, Interneurone genannt, die die Netzwerkaktivität im Gehirn synchronisieren. Sie sind quasi die Taktgeber des Neuronenfeuers im Gehirn. Sie sorgen dafür, dass beim Ableiten der Hirnströme über die Kopfhaut überhaupt rhythmische Signale von den alpha- bis zu den theta-Wellen auf dem Bildschirm zu sehen sind. Die Interneurone ermöglichen höhere kognitive Leistungen wie die Verarbeitung komplexer visueller Reize und die selektive Wahrnehmung, auch das Bewusstsein. Dafür müssen sie allerdings in schnellem Takt stark feuern.
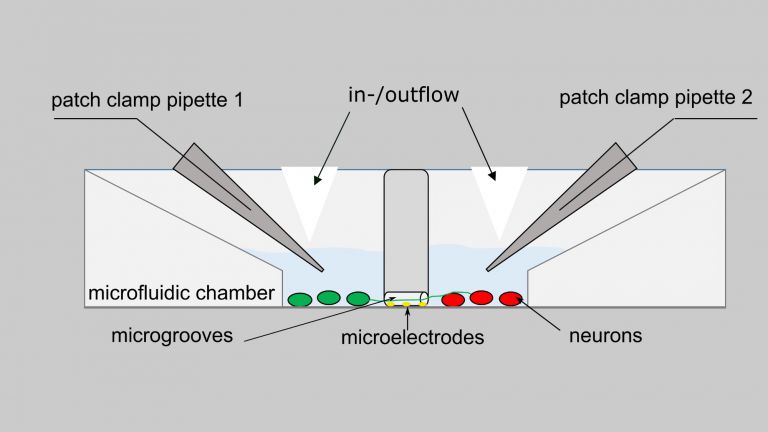
Kanns Team stellte unter Beweis, dass diese Energiefresser im Gehirn als erstes an Funktion einbüßen, wenn es zu mildem Stress auf den Stoffwechsel kommt. Der kann darin bestehen, dass weniger Glucose oder Sauerstoff ins Gehirn kommen oder zu viele freie Radikale anfluten. In weiteren Experimenten an isolierten Hirnschnitten von Ratte und Maus erkannten die Forschenden schließlich auch, dass auch ein gestörter Calcium-Ionen-Haushalt die rhythmische Netzwerkaktivität, den Job der Interneurone, unterminiert. Wahrscheinlich, weil die Mitochondrien nicht richtig arbeiten können, wenn der Calciumeinstrom in die Zelle gestört ist.
Für den Neurowissenschaftler können all diese Befunde ein bemerkenswertes Verhalten des menschlichen Gehirns erklären: An Piloten testete man nach dem Zweiten Weltkrieg, was geschieht, wenn kurzzeitig zu wenig Blut ins Gehirn gelangt. Wie anekdotisch überliefert sei, berichtet Kann, legte man ihnen dafür eine enge Manschette um den Hals. Nach vier bis sechs Sekunden waren sie schon bewusstlos. Doch ihre Nervenzellen feuerten noch weiter. Erst nach einigen Minuten beginnen die Neuronen unterzugehen. Kann sagt: „Das Gehirn hat einfach nicht ausreichend Energiespeicher, um die Interneurone zu versorgen und damit die höheren kognitiven Fähigkeiten aufrechtzuerhalten.“
Frauen bekamen das im 19.Jahrhundert dank der damals vorherrschenden Mode am eigenen Leib zu spüren. Zu eng geschnürte Korsette drückte ihre Atemwegsorgane ab, sodass ihr Gehirn zu wenig Sauerstoff bekam. Mangels Mitochondrien-Power fielen die Frauen dann schon mal zu Boden. Nach der Ohnmacht aber war es, als sei nichts gewesen.
Zum Weiterlesen
- Wei, W et al.: Germline selection shapes human mitochondrial DNA diversity. Science. 2019. 364(6442):eaau6520. doi: 10.1126/science.aau6520 (zum Abstract)
- Bas-Orth, C et al. : The mitochondrial calcium uniporter is crucial for the generation of fast cortical network rhythms. J Cereb Blood Flow Metab. 2020, Nov;40(11):2225–2239. doi: 10.1177/0271678X19887777 (zum Volltext)
- Kann, O. et al.: The interneuron energy hypothesis: Implications for brain disease. Neurobiol Dis. 2016, Jun;90:75–85. doi: 10.1016/j.nbd.2015.08.005 (zum Abstract)
- Elzoheiry, S et al.: Mild metabolic stress is sufficient to disturb the formation of pyramidal cell ensembles during gamma osciallations. J Cereb Blood Flow Metab. 2020 Dec;40(12) :2401–2415. doi: 10.1177/0271678X19892657 (zum Volltext)
- Iwata, R et al.: Mitochondrial dynamics in postmitotic cells regulate neurogenesis. Science. 2020 Aug 14;369(6505):858–862. doi: 10.1126/science.aba9760 (zum Abstract)
- Rangaraju, V et al.: Pleiotropic Mitochondria: The Influence of Mitochondria on Neuronal Development and Disease. J Neurosci. 2019 Oct 16;39(42):8200–8208. doi: 10.1523/JNEUROSCI.1157-19.2019 (zum Volltext)