Geschütztes Herz trotz hohem Blutdruck
Ein überaktives Enzym führt zwar zu erblich bedingtem Bluthochdruck, bewahrt das Herz aber offenbar vor Folgeschäden. Das könnte die Therapie der Herzinsuffizienz grundlegend verändern, berichtet ein Team am Max Delbrück Center, ECRC und DZHK um Enno Klußmann im Fachblatt „Circulation“.
Veröffentlicht: 19.10.2022
Die seltsame Erkrankung erforschen Berliner Wissenschaftlerinnen und Wissenschaftler schon seit Jahrzehnten: In manchen Familien haben die Hälfte der Mitglieder sehr kurze Finger und extrem hohen Blutdruck. Wird dieser nicht behandelt, sterben sie meist schon im Alter von etwa 50 Jahren an einem Schlaganfall. Die Ursache haben Forschende des Berliner Max Delbrück Centers bereits 2015 ausgemacht und fünf Jahre später anhand von Tiermodellen endgültig bewiesen: Ein mutiertes Phosphodiesterase-3A-Gen (PDE3A) bewirkt, dass das kodierte Enzym überaktiv wird. Die Veränderung beeinflusst sowohl das Wachstum der Knochen als auch das der Blutgefäße. Letztere verengen sich, was den erhöhten Blutdruck zur Folge hat.
Vor Folgeschäden gefeit
„Bluthochdruck führt eigentlich fast immer dazu, dass das Herz schwächer wird“, sagt Dr. Enno Klußmann, Leiter der Arbeitsgruppe „Ankerproteine und Signaltransduktion“ am Max Delbrück Center, der auch Wissenschaftler am Deutschen Zentrum für Herz- Kreislauf-Forschung (DZHK) ist. Da das Organ gegen einen höheren Druck anpumpen müsse, versuche es, seine linke Kammer zu stärken. „Doch letztendlich bewirkt dieses verstärkte Wachstum, Herzhypertrophie genannt, dass es irgendwann zu einer Herzinsuffizienz kommt, bei der die Pumpleistung deutlich nachlässt“, erläutert Klußmann.
Genau das geschieht bei den Bluthochdruck-Patient*innen mit den verkürzten Fingern und einem veränderten PDE3A-Gen allerdings nicht. „Aus einem Grund, den wir jetzt im Ansatz, aber noch nicht vollständig verstanden haben, ist ihr Herz vor solchen Folgeschäden des Bluthochdrucks gefeit“, sagt Klußmann.
Die Veröffentlichung im Fachblatt „Circulation“ ist eine Gemeinschaftsarbeit von Forschenden des Max Delbrück Centers, der Charité – Universitätsmedizin Berlin und des DZHK; als Letztautor*innen waren neben Klussmann die Professoren Norbert Hübner und Michael Bader des Max Delbrück Centers sowie Dr. Sylvia Bähring vom Experimental and Clinical Research Center (ECRC), einer gemeinsamen Einrichtung der Charité – Universitätsmedizin Berlin und des Max Delbrück Centers, involviert. Zusammen mit 43 weiteren Forschenden aus Berlin, Bochum, Heidelberg, Kassel, Limburg, Lübeck, Kanada und Neuseeland berichten sie nun, was das Team über die schützenden Effekte der Genmutation herausgefunden hat – und warum die Erkenntnisse die Therapie der Herzinsuffizienz verändern könnten. Die Publikation hat vier Erstautor*innen, drei von ihnen forschen am Max Delbrück Center und einer am ECRC.
Zwei Mutationen, ein Effekt
Ihre Untersuchungen haben die Wissenschaftler*innen zum einen an Menschen mit Hypertonie und Brachydaktylie, also Bluthochdruck und Kurzfingrigkeit (HTNB), vorgenommen, zum anderem an einem Rattenmodell und an Herzmuskelzellen. Letztere hatten sie aus speziell manipulierten Stammzellen, den induzierten pluripotenten Stammzellen, gezüchtet. Sowohl in den Tieren als auch in den Zellen hatten die Forschenden zuvor das PDE3A-Gen gezielt verändert und so die HTNB-Mutationen nachgeahmt.
„Bei den jetzt untersuchten Patient*innen sind wir auf eine bisher unbekannte Mutation des PDE3A-Gens gestoßen“, berichtet Bähring. „Bislang war in dem Enzym immer eine Stelle außerhalb des katalytischen Zentrums verändert gewesen, nun lag die Abweichung genau in diesem Zentrum.“ Erstaunlicherweise hätten aber beide Mutationen den gleichen Effekt: Sie machen das Enzym aktiver als gewöhnlich. Dadurch wird ein wichtiger Botenstoff der Zelle namens cAMP (cyclisches Adenosinmonophosphat), der an der Kontraktion der Herzmuskelzellen beteiligt ist, verstärkt abgebaut. „Möglicherweise können sich durch die Genveränderung – unabhängig von ihrer Position – zwei oder mehr PDE3A-Moleküle zusammenlagern und auf diese Weise effektiver arbeiten“, vermutet Bähring.
Die Proteine bleiben gleich
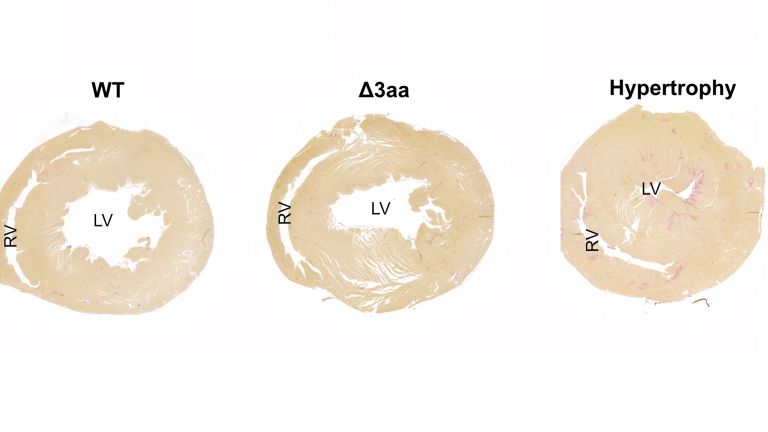
In ihrem Rattenmodell, das die Gruppe von Michael Bader mit der CRISPR/Cas9-Methode am Max Delbrück Center generiert hat, versuchten die Forschenden, die Auswirkungen der Mutationen besser zu verstehen. „Wir haben die Tiere mit dem Wirkstoff Isoproterenol, einem sogenannten Beta-Rezeptor-Agonisten, behandelt“, sagt Klußmann. Solche Medikamente kommen manchmal im Endstadium einer Herzinsuffizienz zum Einsatz. Isoproterenol ist dafür bekannt, das Herz verstärkt wachsen zu lassen. „Bei den genveränderten Ratten geschah dies jedoch erstaunlicherweise nur so, wie wir es auch in den wildtypischen Tieren beobachteten. Wider Erwarten hat der bestehende Bluthochdruck die Situation nicht verschlimmert.“,berichtet Klußmann. „Ihr Herz war ganz offenbar vor diesem Effekt des Wirkstoffs geschützt.“
In weiteren Experimenten untersuchte das Team, ob und wenn ja welche Proteine in einer bestimmten Signalkaskade der Herzmuskelzellen aufgrund der Mutation verändert sind. Über diese Kette chemischer Reaktionen beginnt das Herz, zum Beispiel bei Aufregung, vermehrt Adrenalin auszuschütten und schneller zu schlagen. Adrenalin aktiviert die Beta-Rezeptoren der Zellen, wodurch diese mehr cAMP bilden. Die PDE3A und andere PDE stoppen den Prozess, indem sie cAMP chemisch verändern. „Wir haben allerdings auf der Protein- und auch auf der RNA-Ebene kaum Unterschiede zwischen mutierten und nicht mutierten Ratten gefunden“, sagt Klußmann.
Adrenalin
Adrenalin/-/adrenaline
Along with dopamine and norepinephrine, it belongs to the catecholamines. Adrenaline, also known as epinephrine, is the classic stress hormone. It is produced in the adrenal medulla and causes an increase in heart rate and heartbeat strength, thus preparing the body for increased stress. In the brain, adrenaline also acts as a neurotransmitter (messenger substance), where it binds to so-called adrenoreceptors.
Mehr Kalzium im Cytosol
Der Umbau von cAMP durch die PDE3A erfolgt nicht irgendwo in der Muskelzelle, sondern in der Nähe eines röhrenförmigen Membransystems, das Kalzium-Ionen speichert. Eine Ausschüttung dieser Ionen ins Cytosol der Zelle löst die Muskelkontraktion und somit den Herzschlag aus. Nach der Kontraktion wird das Kalzium durch einen Proteinkomplex in seinen Speicher zurückgepumpt. Auch dieser Prozess wird lokal von PDE gesteuert.
Klußmann und sein Team stellten die Hypothese auf, dass es aufgrund der Hyperaktivität dieser Enzyme rund um die Kalzium-Pumpe weniger cAMP geben müsste – was die Pumpe hemmen würde. „Tatsächlich konnten wir in den genveränderten Herzmuskelzellen nachweisen, dass die Kalzium-Ionen länger als gewöhnlich im Cytosol verbleiben“, sagt Dr. Maria Ercu aus Klußmanns Arbeitsgruppe, die eine der vier Erstautor*innen der Studie ist. Dadurch könnte sich die Kontraktionskraft der Zellen erhöhen.
Nicht hemmen, sondern aktivieren
„Eine akute Herzinsuffizienz wird derzeit oft mit PDE3-Hemmern behandelt, um den cAMP-Spiegel zu erhöhen“, erklärt Klußmann. Eine dauerhafte Therapie mit diesen Wirkstoffen würde den Herzmuskel rasch erschöpfen. „Unsere Ergebnisse deuten nun daraufhin, dass nicht eine Hemmung der PDE3, sondern – im Gegenteil – eine selektive Aktivierung der PDE3A ein neuer und sehr viel besserer Ansatz sein könnte, um durch Bluthochdruck ausgelösten Herzschäden wie einer Herzmuskelhypertrophie und der Herzinsuffizienz vorzubeugen und zu behandeln“, sagt Klußmann.
Zuvor müsse man die protektiven Effekte der Mutation aber noch besser verstehen. „Wir haben beobachtet, dass die PDE3A nicht nur aktiver wird, sondern gleichzeitig ihre Konzentration in den Herzmuskelzellen abnimmt“, berichtet der Forscher. Möglicherweise ließe sich Ersteres durch eine Oligomerisierung erklären – dabei tun sich mindestens zwei Enzymmoleküle zusammen. „In diesem Fall“, sagt Klußmann, „könnten wir vermutlich Strategien entwickeln, um eine lokale Oligomerisierung künstlich in Gang zu setzen – und so den schützenden Effekt für das Herz imitieren.“
Originalpublikation
Maria Ercu et al. (2022): “Mutant phosphodiesterase 3A protects from hypertension-induced cardiac damage”; Circulation, DOI: 10.1161/CIRCULATIONAHA.122.060210