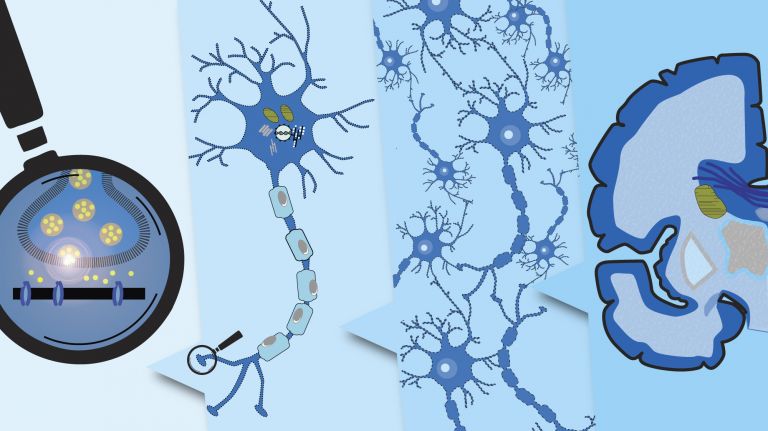
Erfolgsgeheimnis Kommunikation
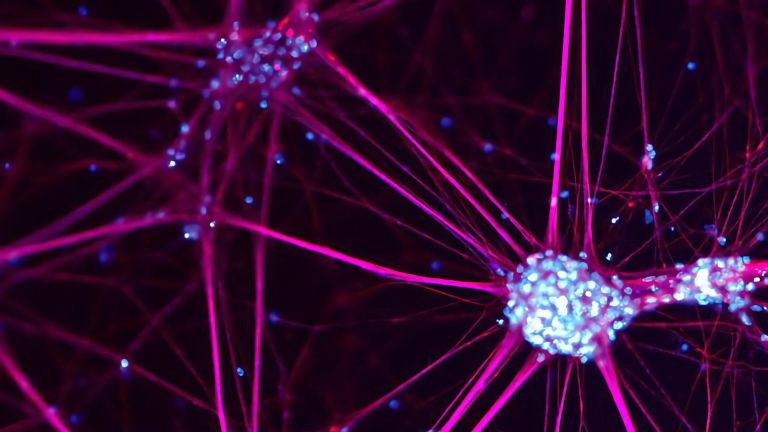
Tausende Antennen, ebenso viele Sender und ein superschnelles Datenkabel erlauben Neuronen den gleichzeitigen Informationsaustausch mit vielen anderen Zellen. Dazwischen werden die Signale räumlich und zeitlich präzise verrechnet.
Scientific support: Prof. Dr. Jochen F. Staiger
Published: 01.12.2020
Difficulty: easy
- Das einzelne Neuron ist strukturell und funktional stark auf Kommunikation spezialisiert. Es trägt tausende sensibler Antennen rund um den Zellkörper, die Dendriten. Es funkt elektrische Signale über ein hocheffizientes Datenkabel, das Axon. Und es gibt seine Botschaften über spezialisierte Sendeknöpfchen an andere Zellen weiter.
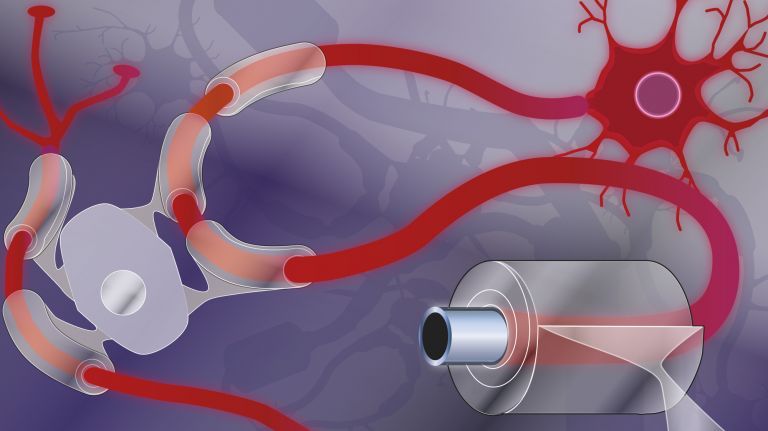
- Die Synapse ist die Schaltstelle der neuronalen Kommunikation. In einer typischen chemischen Synapse schüttet das präsynaptische Endknöpfchen eines Axons Neurotransmitter aus, die durch den synaptischen Spalt zum postsynaptischen Dendrit der Partnerzelle diffundieren und dort an Rezeptoren andocken.
- Die postsynaptischen Rezeptoren reagieren, indem sie Kanäle öffnen, die elektrisch geladene Teilchen (Ionen) aus der Zelle heraus oder in sie hinein lassen. Dadurch verändert sich die Spannung der postsynaptischen Zellmembran. Es entsteht ein postsynaptisches Potential, das erregend oder hemmend sein kann.
- Erreicht die Summe der Spannungsveränderungen der Synapsen einen bestimmten Wert, löst das postsynaptische Neuron ein Aktionspotential aus – ein elektrisches Signal, das entlang des Axons transportiert wird.
- Der Signaltransport verläuft effektiver und schneller, wenn das Axon von einer isolierenden Myelinscheide umgeben ist. Diese wird von spezialisierten Gliazellen gebildet, den Oligodendrozyten.
- Am Ende des Axons löst das Aktionspotential an den Endknöpfchen wieder die Ausschüttung von Neurotransmittern aus. Das nächste Kapitel der Kommunikation beginnt.
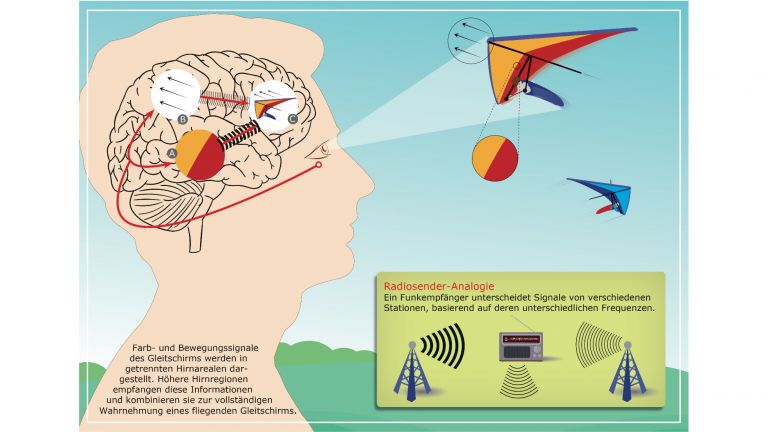
Um die Rolle einzelner Neuronen in einem komplexen System zu verstehen, bietet das Hörsystem beste Voraussetzungen, findet Benedikt Grothe von der Ludwig-Maximilians Universität München: „Damit wir verschiedene gleichzeitig auftretende Schallquellen auseinanderhalten können, hat die Evolution neuronale Schaltkreise an die Grenze dessen gepusht, was überhaupt möglich ist. Da finden wir den ganzen Kosmos möglicher Stellschrauben: ob ein Signal erregend oder hemmend wirkt, welche Neurotransmitter eine Rolle spielen und wie die Zelle die Informationen integriert.“
Feinste Unterschiede im zeitlichen und räumlichen Muster von Tönen erkennen die beteiligten Neuronen dank mehrfacher Spezialisierung. Schon ihre Zellmembran ist so gebaut, dass nur sehr präzise Signale eine Reaktion auslösen. Diese Sensibilität wird durch den zeitlich fein abgestimmten Austausch mit anderen Zellen unterstützt und verfeinert. In elektrophysiologischen Studien mit Wüstenrennmäusen demonstrierten Grothe und seine Kollegen: Hemmende Signale können die Wahrscheinlichkeit, dass die postsynaptische Zelle feuert, nicht nur senken, sondern auch steigern. Die hemmenden Signale senken zunächst das postsynaptische Membranpotential. Dadurch sinkt für kurze Zeit der Schwellenwert für ein Aktionspotential und macht das postsynaptische Neuron empfänglicher für erregende Signale. Es reagiert dann innerhalb dieses Zeitfensters von wenigen Mikrosekunden auch auf solche Reize, die sonst kein Aktionspotenzial auslösen würden. Solche Präzision auf der Ebene der einzelnen Zelle hilft dem Gehirn beispielsweise dabei, feine Details von sich bewegenden schwachen Geräuschquellen zu erkennen und zu analysieren.
Auch bei der Unterscheidung sehr ähnlicher Laute kann die präzise zeitliche Steuerung hemmender Signale und die Reaktion einzelner Zellen darauf eine Rolle spielen. Die Silben „ba“ und „pa“ unterscheiden sich beispielsweise nur durch eine subtile Lücke – beziehungsweise ihr Fehlen – am Ende des jeweiligen Konsonanten. Einige an der Signalverarbeitung beteiligten Neuronen reagieren darauf unter anderem mit dem plötzlichen Beenden eines hemmenden Signals. Dadurch schießt das bis dahin gehemmte postsynaptische Neuron in ein Aktionspotenzial über, feuert und zeigt damit die Lücke an.
Im Zentrum neuronaler Schaltkreise stehen einzelne Nervenzellen. Sie sind die kleinste Einheit des Gehirns und doch viel mehr als schlichte Bausteine. Schon ihre äußere Form deutet auf Komplexität hin. Neuronen sind wie kaum ein anderer Zelltyp extrem polarisiert. Mit ihren drei ikonischen Komponenten erinnern sie entfernt an einen Baum: mit einer vielfältig verästelten Dendritenkrone rund um den Zellkörper, einem zentralen Stamm – dem Axon – und vielfältigen weiteren Verzweigungen im Wurzelwerk der Synapsen. Aus der Nähe betrachtet zeigt sich, dass die Funktion und das Zusammenspiel dieser Komponenten, dem Neuron seine besonderen Fähigkeiten verleihen – als Datenkrake und Supercomputer. Neurone sind darauf spezialisiert, Informationen zu sammeln, zu verarbeiten und weiter zu verteilen. Sie sind Meister der Kommunikation. Sowohl für den Austausch als auch für die Verarbeitung von Informationen zählen dabei nicht zuletzt die äußeren Werte der Nervenzelle – nämlich feine Unterschiede in der Chemie und Elektrizität an der Zelloberfläche.
Erstaunlich viele Werkzeuge für die Kommunikation sitzen daher direkt in der Zellmembran. Sie ist viel mehr als eine Hülle, die einzelne Neuronen von ihrer Umgebung abtrennt. Vielmehr beherbergt sie Kanäle, Pumpen, Rezeptoren – Arbeitsgeräte der Nervenzelle, um Informationen zu empfangen, weiterzuleiten und zu verarbeiten.
Kontaktstellen der Kommunikation
Schnittstelle für den Informationsaustausch ist die Synapse ▸ Was Nerven verbindet. Nervenzellen sind in bis zu zehntausend dieser Kontaktstrukturen involviert. Die Grundidee ist schlicht: Es gibt einen präsynaptischen Teil, der Signale aussendet, einen synaptischen Spalt, den die Signale überqueren und einen postsynaptischen Teil, der sie empfängt. Den präsynaptischen Teil stellen die Endknöpfchen der Axone im Wurzelbereich einer Nervenzelle, den postsynaptischen Teil die Dendriten und der Zellkörper. Neurone vernetzen sich also Kopf an Fuß und trennen meist strikt zwischen Informationsaufnahme (über die Dendriten und Zellkörper) und Informationsausgabe (über das Axon). In einer typischen Synapse schüttet das Endknöpfchen chemische Signale (Neurotransmitter) aus, die an spezialisierte Rezeptorproteine in der gegenüberliegenden postsynaptischen Membran andocken und dort eine Reaktion auslösen. Daneben existieren die selteneren elektrischen Synapsen. Hier sind die prä- und postsynaptischen Zellen über gemeinsam gebildete Ionenkanäle miteinander verknüpft, fachlich Gap Junctions genannt. Darüber tauschen sie elektrisch geladene Teilchen (Ionen) aus.
Aus elektrischen Signalen werden Botschaften
Hauptsprache der Nervenzellen ist Elektrizität. Auch die Informationen an einer chemischen Synapse wandelt die Empfängerzelle sofort wieder in bioelektrische Signale um und transportiert diese über ihr Axon bis in die eigenen präsynaptischen Regionen. Die Übersetzungsarbeit leisten Ionenkanäle in der Zellmembran ▸ Kommunikationslöcher: Ionenkanäle, die direkt oder indirekt an die Neurotransmitter-Rezeptoren gekoppelt sind. Dockt ein Transmittermolekül an den Rezeptor an, öffnet (oder schließt) sich der Ionenkanal und lässt – je nach Konfiguration der Transmitter und Kanäle – mehr (oder weniger) positiv geladene Natrium-, Calzium- oder Kaliumionen oder negativ geladene Chlorionen die Zellmembran überqueren. Dadurch verändern sich die elektrischen Ladungen im Zellinnern sowie in der Umgebungsflüssigkeit – und damit auch die elektrische Spannung zwischen diesen beiden Bereichen: das Membranpotential. Die so entstehende Spannungsänderung bezeichnet man als postsynaptisches Potential.
Je nachdem, welche Neurotransmitter und welche Kanäle an einer Synapse im Spiel sind und wie die Ionen in dem spezifischen Neuron verteilt sind, kann ein postsynaptisches Potential erregend oder hemmend sein und unterschiedlich stark ausfallen. Mit seiner individuellen qualitativen und quantitativen Signatur funktioniert jedes postsynaptische Potential wie ein Informationsbeitrag in der bioelektrischen Kommunikation der Nervenzellen.
Da ein typisches Neuron über viele tausend Orte an den Dendriten Signale von anderen Zellen empfängt, muss es diese Signalfülle mit ihren zeitlichen und räumlichen Mustern zu einer sinnvollen Gesamtbotschaft integrieren – eine überaus komplexe Rechenaufgabe. Das Ergebnis dieser Rechenleistung beeinflusst, wie das Neuron sich im nächsten Schritt verhält: Schickt es über ein Aktionspotential in die eigenen präsynaptischen Regionen und damit Signale an andere Zellen oder nicht?
Im Ruhezustand herrscht ein negatives Membranpotential von ca. -70 mV vor, bei dem im Zellinneren weniger positiv geladene Teilchen vorhanden sind als außerhalb. Steigt das Membranpotential infolge der Gesamtschau der empfangenen Signale über einen bestimmten Schwellenwert (ca. -55 mV), öffnen sich weitere spannungsgesteuerte Ionenkanäle, die schlagartig viele positiv geladene Natriumionen in das Zellinnere strömen lassen. Dadurch schnellt das Membranpotential in diesem Bereich weiter nach oben. Es entsteht ein Aktionspotential, das sich nun in einer Kettenreaktion entlang des Axons fortpflanzt, bis es die präsynaptischen Endungen und das Signal über die dort liegenden Synapsen die nächsten Staffelmitglieder im neuronalen Netzwerk erreicht. Das Neuron hat „gefeuert“.
Recommended articles
Hopp oder Top: Das Aktionspotential
Im Gegensatz zu postsynaptischen Potentialen können Aktionspotentiale bei Wirbeltieren nicht stärker oder schwächer ausfallen. Ihr Informationsgehalt liegt stattdessen darin, ob sie überhaupt entstehen – und wie oft. Entscheidend ist zudem die Geschwindigkeit, mit der sie ihre Ziele flussabwärts in der Informationskaskade erreichen. Dabei kommt es auf feinste Unterschiede an – zum Beispiel auf wenige Mikrosekunden bei der Unterscheidung verschiedener Töne im auditorischen System (siehe Box).
Aktionspotentiale müssen mitunter riesige Distanzen überwinden – Axone werden, je nach Organismus, bis zu vielen Metern lang. Wie schnell die Signale reisen, hängt von der Dicke des Axons ab, beziehungsweise davon, wie gut es elektrisch isoliert ist ▸ Highspeed dank Myelin. Bei Wirbeltieren umwickeln spezialisierte Gliazellen, die Oligodendrozyten, das Axon und bilden eine Myelinscheide, vergleichbar mit der Hülle um ein elektrisches Kabel. Nur an gelegentlich auftretenden Lücken, den so genannten Ranvier-Schnürringen, liegt die Zellmembran des Axons frei. Und nur hier wiederholt sich in wirksamer Weise der plötzliche Ionenaustausch und die damit verbundene Veränderung der elektrischen Spannung, die das Aktionspotential zur Weiterreise braucht. Innerhalb der elektrisch isolierten Zwischenstücke des Axons wird die Spannungsdifferenz hingegen fast ohne Zeitverlust durch ein elektrisches Feld weitergegeben. Dieses schubst auch weiter entfernte Ionen im Zellinnern ausreichend an, um am nächsten Schnürring die Bedingungen dafür zu schaffen, dass sich die spannungsgesteuerten Ionenkanäle dort öffnen. Das Aktionspotential „springt“ so von Ring zu Ring.
Erreicht das Aktionspotential schließlich die Endknöpfchen des Axons, löst es dort die Öffnung weiterer Ionenkanäle aus, die Calziumionen ins Zellinnere strömen lassen. Die erhöhte Konzentration an Calziumionen wiederum dient als Signal für die Freisetzung von Neurotransmittern in den synaptischen Spalt, und so erreicht das Signal die nächste Zelle. Der aktuelle Kommunikationsbeitrag des Neurons ist damit abgeschlossen. Die Nervenzelle kann allerdings auch längerfristiger auf die Kommunikation reagieren, an der sie sich beteiligt – indem sie etwa viel genutzte Synapsen stärkt, wenig genutzte schwächt oder abbaut, aber auch neue Synapsen ausbildet. Durch diese synaptische Plastizität verändern sich die kommunikativen Kapazitäten dieser Neuronen und des Gehirns ständig – man lernt, bildet neue Erinnerungen und vergisst andere.
Nur eine Zelle unter Milliarden?
Angesichts von ungefähr 86 Milliarden Neuronen im menschlichen Gehirn, stellt sich die Frage, welche Rolle eine einzelne Zelle in diesem komplexen und dynamischen Gefüge spielen kann. In Anbetracht der Tatsache, dass jedes Neuron viele tausend zeitlich und räumlich strukturierte hemmende und erregenden Signale pro Millisekunde verrechnet, sie in elektrische Signalfrequenzen bis zu 1000 Hertz übersetzt und die Botschaft schließlich über präzis getunte Axone verschickt, lautet die Antwort: eine beachtliche. Der 2018 in Betrieb genommene Supercomputer „ SpiNNaker“, der eine Milliarde vernetzte Nervenzellen zu simulieren versucht, hat über eine Million Rechenkerne, von denen jeder 100 Neuronen mit 10.000 Synapsen nachstellen soll. Ein aktueller Hochleistungslaptop hat 8 Kerne. Rechnet man das grob zurück, dann schafft eine durchschnittliche Nervenzelle im menschlichen Gehirn immerhin ein Achthundertstel der Rechenleistung eines MacBook Pro. Nicht schlecht für nur eine einzelne Zelle.
Zum Weiterlesen
- Hammond, Constance : Cellular and Molecular Neurophysiology , Academic Press (2015)
- Koch, Christof : Biophysics of Computation: Information Processing in Single Neurons, Oxford University Press: New York (1999)
- Beiderbeck B et al: Precisely timed inhibition facilitates action potential firing for spatial coding in the auditory brainstem. Nature Communications. (2018)9:1771 ( zum Volltext ).