Das Neuronengeflecht entwirren
Um Nervenbahnen und Netzwerke im Gehirn zu verfolgen, bedarf es ausgeklügelter Technologien, vor allem aber viel Geduld und Liebe zum Detail
Scientific support: Prof. Dr. Markus Morawski
Published: 30.04.2021
Difficulty: intermediate
- Für die Verbindungen zwischen den Zellen des Nervensystems interessierten sich bereits vor 140 Jahren Anatomen wie Santiago Ramon y Cayal und Camillo Golgi.
- Erst raffinierte Färbetechniken ermöglichten es, den Verlauf und die Verbindungen einzelner Neurone nachzuzeichnen.
- Die Darstellung von Details war erst nach Erfindung des Elektronenmikroskops möglich.
- Größere Netzwerke erfordern die Automatisierung der Arbeitsabläufe, bei denen spezielle Präparationstechniken und Schneidegeräte (Mikrotome) mit Mikroskopen kombiniert werden, die Proben mit bis zu 91 Elektronenstrahlen gleichzeitig durchleuchten.
- Um Feinstrukturen wie Synapsen sicher zu identifizieren, braucht es zusätzlich zu spezieller selbstlernender Software noch immer menschliche Spezialisten und deren Hintergrundwissen.
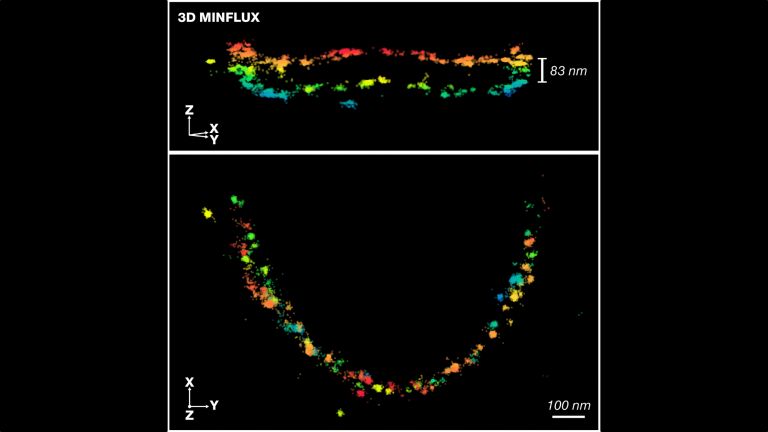
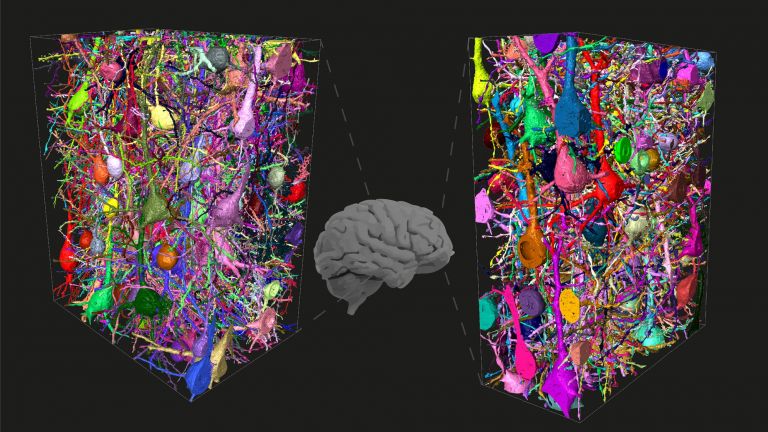
- Das größte Stück Hirngewebe, das bisher digital erfasst und in allen Details dargestellt wurde, hat ein Volumen von einem Kubikmillimeter. Dies entspricht einem Fünfhundertstel des Gehirns einer Maus.
- Noch vor Vollendung des Konnektoms haben Forscher bereits begonnen, sich der Gesamtheit aller Synapsen zuzuwenden (Synaptom). Manche wollen gar den Aktivitätszustand ganzer Nervensysteme erfassen, das „Dynom“.
Eine der neuesten Techniken der Neuroforscher erlaubt es, am lebenden Gehirn die Nervenbahnen zwischen verschiedenen Regionen sichtbar zu machen: Die Diffusions-Tensor-Bildgebung (nach dem englischen abgekürzt DTI) ist eine spezielle Form der Magnetresonanztomografie, welche die Bewegung von Wassermolekülen messen kann. Da Nervenfasern von einer fetthaltigen Hülle umgeben sind, diffundieren die Wassermoleküle viel leichter entlang der Fasern als durch die Hülle hindurch – ein Unterschied, aus dem der Computer den Verlauf der Nervenbahnen herauszurechnen vermag. So entstehen dreidimensionale Karten, in denen die Nervenbahnen als bunte Stränge erscheinen. Welche Regionen zusammenarbeiten, erkennen die Forscher, indem sie Aufnahmen vergleichen zwischen dem Gehirn in Ruhezustand und bei bestimmten Übungen, zum Beispiel für das Gedächtnis. Unterschiede – beispielsweise zwischen Menschen mit und ohne psychische Störungen – dienen als Anhaltspunkte, wo genau die Kommunikation innerhalb des Gehirns schiefläuft. Mit der verhältnismäßig kleinen Summe von 40 Millionen Dollar wurde übrigens bereits im Jahr 2009 in den USA das Human Connectome Project auf den Weg gebracht, um den Verlauf aller Nervenbahnen zwischen mindestens 360 Hirnregionen vom Baby bis zum Greisenalter zu erfassen. Die Ergebnisse von 20 einzelnen Studien fanden ihren Niederschlag in mittlerweile über 800 Publikationen.
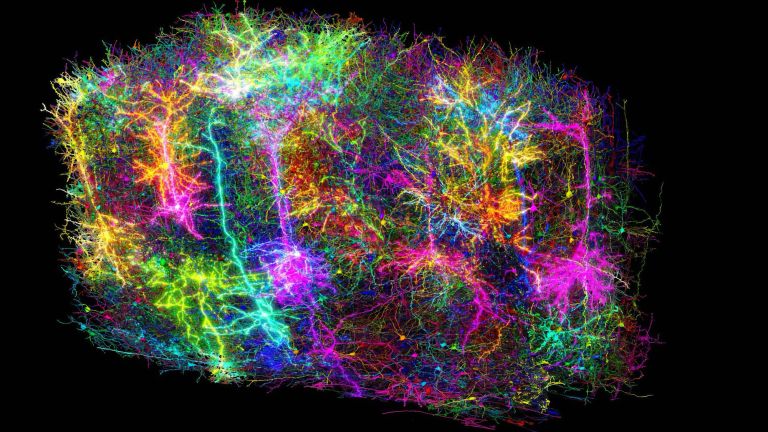
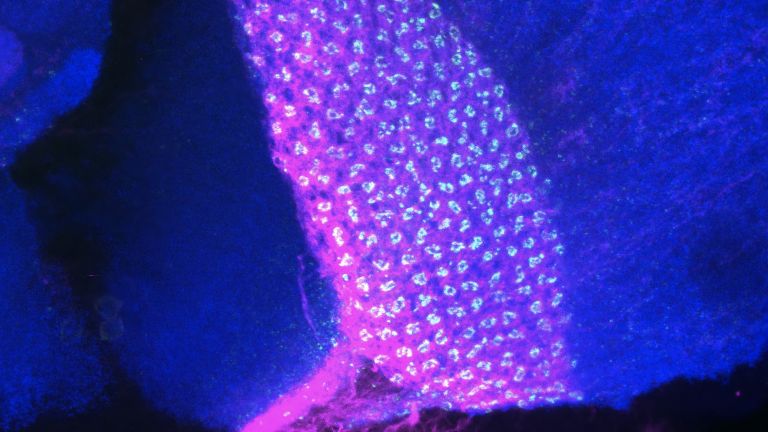
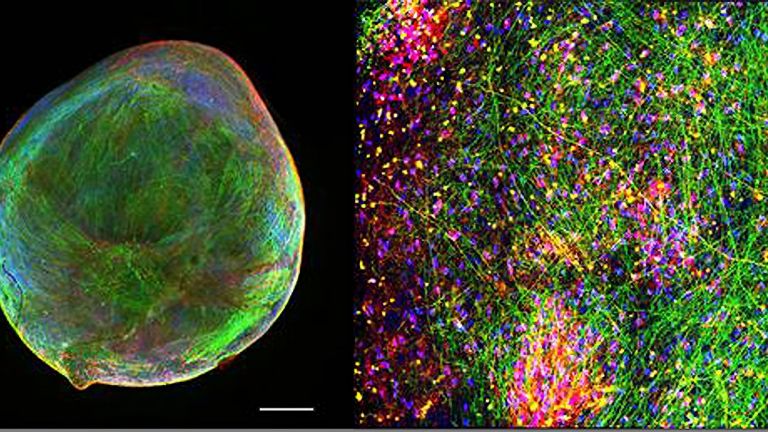
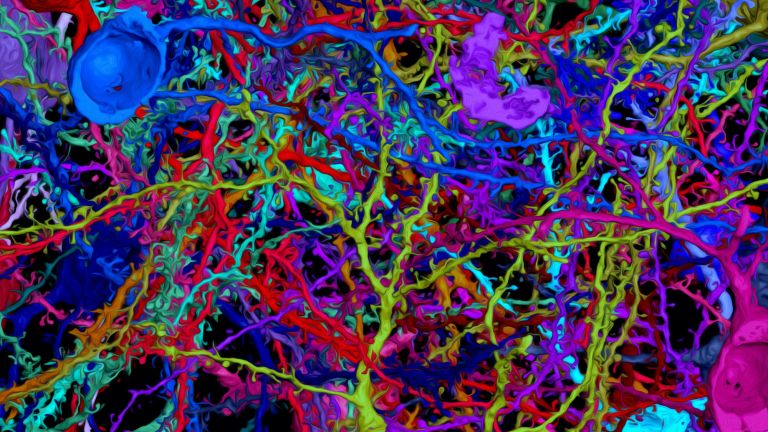
Das Forschungsgebiet der Konnektomik hat nicht nur zahlreiche Tüftler und Erfinder zu bieten, sondern auch wahre Kunstwerke hervorgebracht. In der Neuzeit verblüffte insbesondere Jeff W. Lichtman seine Kollegen mit der „Brainbow“-Technik, die er an der Harvard University entwickelt hat. Ähnlich wie bei einem Kabelstrang die einzelnen Leitungen mit verschiedenen Farben gekennzeichnet sind, ist dies Lichtman mit einzelnen Neuronen gelungen. Er nutzte dafür die Erbinformationen für mehrere Proteine, die unter fluoreszierendem Licht in unterschiedlichen Farben leuchten. Diese Erbinformationen werden aneinandergereiht und jeweils durch genetische Signalelemente voneinander getrennt. Im nächsten Schritt werden diese „Kassetten“ in das Genom von Versuchstieren eingeschleust, und zwar zusammen mit der Erbinformation für ein Enzym (Cre-Rekombinase), welches in zufälliger Weise an die Signalelemente bindet und dadurch die Erbinformationen durcheinanderwürfelt, sodass die Maschinerie der Zelle eine Kombination verschiedener „Leuchtmoleküle“ produziert. In bis zu 100 verschiedenen Farbnuancen leuchten die nunmehr klar unterscheidbaren Neuronen schließlich unter dem Mikroskop, wenn Wissenschaftler schließlich die Hirnschnitte mit Fluoreszenzlicht bestrahlen – ein Anblick, der sicher auch Pioniere der Neuroanatomie wie Santiago Ramón y Cayal begeistert hätte.
Die Aufgabe: Wir entwirren einen Haufen Spaghetti. Die Spielregeln: Die Lage jeder einzelnen Nudel und deren Verlauf sind feinsäuberlich zu erfassen, außerdem müssen alle Kontaktstellen mit den Nachbarn exakt kartiert werden.
Was bei einem kleinen Teller bereits eine gewaltige Herausforderung wäre, würde bereits bei einem Topf zur Strafe. Und wenn der Haufen nicht wie der Inhalt einer typischen Packung aus 500 oder 600 Spaghetti bestünde, sondern gleich ein ganzer Berg wäre?
Der Berg, um den es hier geht, ist das menschliche Gehirn mit seinen geschätzt 86 Milliarden Nervenzellen – was in etwa 15 Millionen Packungen Spaghetti entspricht. Was die Sache noch komplizierter macht: Wir haben nicht nur eine Sorte von Nervenzellen im Kopf, sondern Dutzende oder gar Hunderte verschiedene Typen. Wie also soll das gehen? Welche Methoden, welche Geräte braucht es zur Darstellung des „Konnektoms“ – also sämtlicher Zellen und Zellbestandteile des Gehirns und ihrer Verbindungen?
Unendliche Geduld, Liebe zum Detail, künstlerische Begabung und auch ein wenig Glück brachte der spanische Mediziner und Histologe Santiago Ramón y Cayal als Startkapital ein. Jeder Student der Neurowissenschaften kennt die Zeichnungen, die Cayal vor etwa 140 Jahren angefertigt hat: Ästhetisch und präzise zugleich zeigen sie Hirnzellen von Hühnern, Spatzen oder Tauben mit nie zuvor gesehenen Details. Was bis dato nur eine verschwommene Masse war, offenbarte sich dank einer von Cayals Konkurrenten, Camillo Golgi, entwickelten Technik zur „Versilberung“ von Nervenzellen unter dem Mikroskop als Ansammlung faszinierender und klar unterscheidbarer Strukturen.
Unsichtbare Verbindungen
Niemand weiß, warum die eingesetzten Silbersalze nur einzelne Nervenzellen sichtbar machten und aus der Masse der gleich gestalteten Nachbarn hervorhoben. Baumartig erschienen die Zellen aus einer Hirnregion, spinnenförmig die einer anderen. Manche sind mehr, andere weniger stark verästelt. Doch wie hängt das alles zusammen?
Während Golgi ein durchgängig miteinander verknüpftes Netzwerk zu sehen glaubte, postulierte Cayal, dass es zwar Kontaktstellen gäbe, diese aber nicht beständig seien und nur bei der Kommunikation genutzt würden. Cayal sollte recht behalten. Sehen konnte man dies damals allerdings nicht, da die Auflösung der Lichtmikroskope dafür nicht ausreichte. So erhielten beide Konkurrenten 1906 gemeinsam den Nobelpreis für Medizin „in Anerkennung ihrer Arbeit über die Struktur des Nervensystems“ > Kampf um die Neuronendoktrin .
Die Leistungsfähigkeit der Mikroskope hat sich seitdem beständig verbessert > Mikroskopie . Mit der Einführung der Elektronenmikroskopie vor etwa 75 Jahren stieg die Auflösung um das 1000-fache: auf etwa ein Zehnmillionstel Millimeter (0,1 Nanometer). Es folgten Laserstrahlen zur Verfolgung fluoreszierender Moleküle im Gewebe und Computer, mit denen diese Informationen in digitale Bilder und Datenbanken umgewandelt werden. Buchstäblich für mehr Durchblick sorgt heute auch die bereits 1914 in Leipzig von Werner Spalteholz entwickelte Technik zum Durchsichtigmachen von großen Gewebestücken oder ganzen Organen (CLARITY), die Spalteholz´ Nachfolger für hochaufgelöste 3D-Darstellungen nutzen.
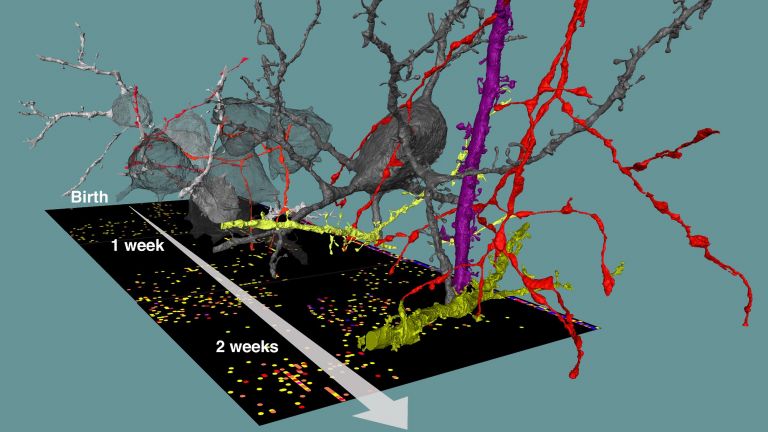
Lange Zeit jedoch blieb das Gewirr der Nervenzellfortsätze (Neuropil) für Neuroanatomen und Histologen undurchdringlicher als jeder Dschungel. Gesucht wurde eine Methode, um einzelne Nervenzellfortsätze oder ganze Nervenstränge zu verfolgen. Die kam in den späten 1960er Jahren, als Zellbiologen mit radioaktiv markierten Aminosäuren arbeiteten, die sie in die Zellkörper von Neuronen injizierten. Als Bestandteil neu synthetisierter Proteine wanderten einige der Aminosäuren entlang der Axone zu den Nervenenden – und hinterließen eine schwarze Spur, wenn man die entsprechenden Gewebeschnitte mit Fotopapier bedeckte. Die Zellbiologen hatten somit nicht nur den schnellen axonalen Transport mit Geschwindigkeiten von bis zu einem Meter am Tag dokumentiert, sondern den Neuroanatomen auch ein neues Werkzeug an die Hand gegeben, so genannte Tracer, mit denen sich Nervenbahnen im Gehirn wie Spuren verfolgen lassen.
Meerrettich und Herpesviren
Auch der Gegenverkehr – also der retrograde axonale Transport – lässt sich verfolgen. Dazu wird das Enzym Meerrettich-Peroxidase ins Gehirn gespritzt, wo es von den Enden der Axone aufgenommen und zum Zellkörper transportiert wird. Später wird das Versuchstier geopfert, und die Meerrettich-Peroxidase in den Gewebeschnitten bildet unter Zugabe bestimmter Chemikalien bunt-farbige Reaktionsprodukte. So wird unter dem Mikroskop schließlich der Verlauf der Fasern durch das Gehirn und ein möglicher Zusammenhang einzelner Neurone sichtbar. Auch Herpesviren können – beispielsweise an Mund und Lippen – in Axone eindringen und wandern von dort zum Zellkörper. In Tierversuchen lassen sich bestimmte Stämme in ausgewählte Hirnregionen spritzen. Deren Wanderung durch benachbarte Neurone können Forscher dann nach einigen Tagen mit Hilfe von Antikörpern sichtbar machen . Ebenso wie die Gerätschaften wurden auch diese Tracer ständig weiterentwickelt, sodass den Laboren eine ganze Palette von synthetischen Molekülen für die verschiedensten Einsatzzwecke zur Verfügung steht, darunter die Carbozyanine, biotyniliertes Dextranamin und Fluorogold.
Tatsächlich gelang es den Pionieren des Neurotracings Jahrzehnte bevor der Begriff „Konnektom“ überhaupt erfunden wurde, einige wenige neuronale Schaltkreise darzustellen. In den 1980er Jahren erreichten einige sehr geduldige Doktoranden einen Meilenstein, indem sie erstmals das vollständige Nervensystem eines Organismus kartierten. Es handelte sich dabei um das „Nervenkostüm“ des Fadenwurms Caenorhabditis elegans mit seinen rund 7.000 Verbindungen zwischen exakt 302 Nervenzellen. Damit waren dann allerdings sowohl die Grenzen der damaligen Technik erreicht als auch der menschlichen Leidensfähigkeit, denn es ist eine furchtbare Arbeit, jeden Tag stundenlang durchs Mikroskop zu schauen und kaum sichtbare Details nachzuzeichnen.
Schnelle Computer und scharfe Messer
Klar war: Um selbst kleinste Gehirne komplett zu erfassen, bedurfte es völlig neuer Methoden. Und statt Hunderten von Doktoranden stupide Handarbeiten abzufordern, sollten diese Methoden möglichst weitgehend automatisiert werden. Nach Schätzungen liefert bereits ein Kubikmillimeter Hirngewebe eine Informationsmenge von mehreren Petabytes, also etwa das Tausendfache des Speichers eines modernen Heimcomputers. Dies zu verarbeiten, erfordert nicht nur Rechner mit entsprechend gewaltiger Geschwindigkeit und Speicherkapazität, sondern auch spezielle Programme, deren Algorithmen sowohl Muster in der Datenflut erkennen können, als auch diese Daten in anschaulicher Form darstellen.
Ebenfalls Teil des Geräteparks sind die wohl leistungsfähigsten Messer der Welt. Sie wurden von Kenneth J. Hayworth am Harvard Center for Brain Science entwickelt und haben Klingen aus synthetischen Diamanten. Die fortschrittlichsten dieser Schneidegeräte (Ultramikrotome) trennen Hirngewebe in Scheiben von weniger als 3 Millionstel Millimeter (30 Nanometer) Dicke und verfügen auch noch über einen Mechanismus, um die Schnitte automatisch einzusammeln und anzuordnen, sodass sie von Elektronenmikroskopen abgetastet werden können.
Recommended articles
Elektronenmikroskopie am Fließband
Dieses Prinzip der Serien-Block-Elektronenmikroskopie (SBEM) bekam in den letzten Jahren Konkurrenz durch eine weitere Variante, bei der die Dünnschnitte entfallen. Stattdessen werden kleine Blocks von Hirngewebe direkt im Gerät montiert und schichtweise von oben erfasst. Ein Ionenstrahl trägt die oberste Schicht ab, und das Gerät analysiert die nächste Schicht. Der Vorgang kann an einem einzigen Präparat mehrere Tausend Male wiederholt werden. Die „FIB-SBEM“ abgekürzte Methode liefert also auf direkterem Wege perfekt ausgerichtete Stapel digitaler Elektronenmikroskopien, mit denen sich der Verlauf neuronaler Fortsätze verfolgen lässt. Fehler darf man dabei allerdings nicht machen. Schließlich wird jeder Schnitt nach der Aufnahme verdampft, sodass man ihn kein zweites Mal aufnehmen kann.
Geht alles gut, ist die Auflösung der FIB-SBEM jedoch besser als bei der „einfachen SBEM und die Schichtdicke sinkt nochmals um den Faktor 10 auf kaum vorstellbare zwei Nanometer. Der Preis dafür ist allerdings ein Sichtfeld, das wesentlich kleiner ist als bei der „Diamantmesser-SBEM“. Doch schon haben die zahlreichen Tüftler unter den Konnektom-Forschern die nächste Stufe erdacht, die die Ionen-Schichtmikroskopie mit den Diamantmessern kombiniert. Hier werden nun die Miniblocks von Hirngewebe mit Schwermetallen gefärbt und in Epoxidharz eingebettet. Erhitzte und mit einer speziellen Schmierflüssigkeit benetzte Diamantmesser vermögen diese harten Brocken zu schneiden – und die Vorteile beider Methoden zu kombinieren.
Auch die Lichtmikroskopie ist beim Konnektom-Projekt mit an Bord. Hier wurden ebenfalls technische Verbesserungen mit neuen Methoden kombiniert, um tiefer ins Gewebe einzudringen, Unschärfen zu eliminieren und die Auflösung zu verbessern. So liefert die Lichtscheibenmikroskopie eine Auflösung von 100–300 Nanometern. In Kombination mit den Klarifizierungstechniken, die dem Gewebe Lipide entziehen, um es durchsichtiger zu machen, reicht das aus, um nicht nur Zellen und Neurone zu erfassen, sondern sogar einzelne Synapsen.
Dennoch: Es würde mehrere tausend Jahre in Anspruch nehmen, wollten Wissenschaftler auf diese Weise die Daten eines Spatzen- oder Mäusehirns sammeln. Aber auch für dieses Problem gibt es eine Lösung: So arbeiten manche neuere Elektronenmikroskope statt mit einem einzigen Elektronenstrahl mit einer Vielzahl identischer Einheiten im gleichen Gehäuse. Bis zu 91 Einheiten sind es bei der jüngsten Gerätegeneration – und entsprechend viele Schnitte können sie in einem Arbeitsgang fotografieren und die Daten zur Weiterverarbeitung an den Rechner übergeben. Da man auch diese Maschinen wiederum gleich reihenweise ins Labor stellen könnte, wird Geld zum wichtigsten limitierenden Faktor.
Heiße Diamanten und neuronale Netze
Liegen die Daten erst einmal auf dem Computer, gilt es, diese auch richtig zu interpretieren. Hier kommen Forscher wie Winfried Denk ins Spiel, der mit seinen Kollegen am Max-Planck-Institut für Biomedizinische Forschung in Heidelberg eine Methode ersonnen hat, um miteinander verbundene Neurone zu erkennen und zu markieren. Und im Labor von Sebastian Seung am Massachussetts Institute of Technology haben die beiden Studenten Viren Jain und Srini Turaga ein Programm auf Basis der künstlichen Intelligenz (KI) geschrieben, das lernen kann, Synapsen zu erkennen, wenn es die Neurowissenschaftler eine Zeitlang bei der Arbeit verfolgt. Beide Wissenschaftler sind dem Konnektom treu geblieben und leiten inzwischen ihre eigenen Forschergruppen – Jain bei der KI-Abteilung von Google, und Turaga am berühmten Janelia Research Campus des Howard Hughes Medical Institute.
Die Software zur Rekonstruktion der Schaltkreise aus den Daten beruht ironischerweise selbst auf dem Prinzip neuronaler Netze. Hier könnten die besten Algorithmen es bezüglich der Fehlerquote mit durchschnittlich motivierten Forschern aufnehmen, schrieben der mittlerweile ans Max-Planck-Institut für Neurobiologie (bei München) umgezogene Winfried Denk und sein Postdoc Jörgen Kornfeld bereits 2018 in einer Übersichtsarbeit . Aber der Teufel steckt oftmals im Detail. Während nämlich menschliche Fehler zufällig passieren, und sich dadurch „ausmitteln“, sind Fehler in der Software systematischer Art. Die Maschinen scheitern häufig an einander ähnlichen Strukturen, die nur unter Einbeziehung der Umgebung und von Kontext-Wissen unterschieden werden können. „Zum Glück gibt es hochgradig motivierte und gebildete Menschen wie fortgeschrittene Studenten und Postdocs, die fast alle diese Fehler korrigieren können“, so Denk.
Mehrere Meilensteine hat Denk bereits erreicht, und – zusammen mit seinem Kollegen Moritz Helmstaedter (Interview) – einige der bislang größten „Brocken“ von Hirngewebe mit den feinsten Details erfasst. Rekordhalter ist vermutlich das Allen Institute for Brain Science in Seattle, wo im April 2019 der erste Kubikmillimeter Mäusehirn gefeiert wurde. Etwa 100.000 Neuronen und 1 Milliarde Synapsen stecken in dem Gebilde, das etwa die Größe eines Sandkorns hat und anhand von mehr als 100 Millionen Bildern digitalisiert wurde. Das kartierte Volumen entspricht zwar nur einem Fünfhundertstel des Mäusegehirns, doch Denk ist Optimist: In der Summe seien die Fortschritte so groß, dass man erwarten dürfe, binnen zehn Jahren das Gehirn eines kleinen Säugers oder Vogels vollständig zu erfassen.
Der eingangs erwähnte Berg von Spaghetti wäre damit zwar erobert, doch der Hunger der Wissenschaftler ist längst nicht gestillt. Schon sprechen sie vom Synaptom – der Welt der Synapsen. Die liegt mehrere Größenordnungen unterhalb des eigentlichen Konnektoms, ist aber doch zu dessen Verständnis unentbehrlich, heißt es. Und wenn man alle Verbindungen hat, ist die Arbeit längst noch nicht getan, argumentierte bereits 2014 eine Gruppe Mathematiker von der Universität Boston. Das „Dynom“ müsse nämlich ebenfalls verstanden werden, indem man Momentaufnahmen der Aktivität des kompletten Nervensystems erstellt, sagten sie – und veröffentlichten auch gleich einen Forschungsrahmen mit Arbeitsvorschlägen für die Kollegen. Mehr als 100 Fachartikel verweisen bereits auf diesen Anstoß, und man darf gespannt sein, welches „…om“ das nächste Großprojekt der Hirnforschung sein wird.