Die Rolle der Mikroglia beim Schlaganfall
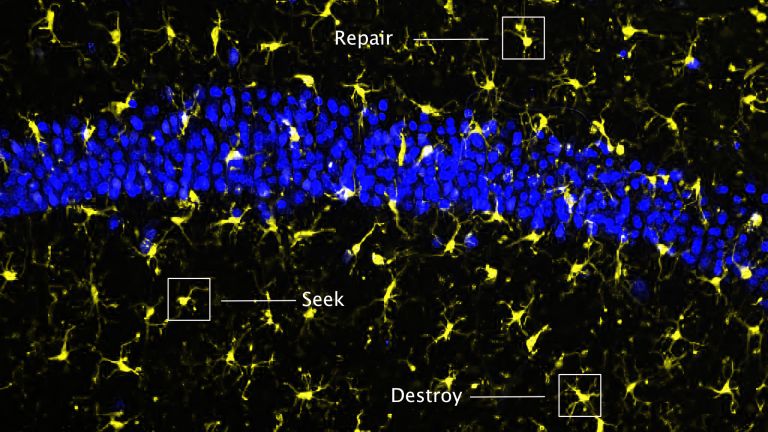
Mikroglia sind die Immunzellen des Nervensystems. Nach Schlaganfällen üben sie ebenso positive, wie negative Einflüsse aus. Genau das macht sie so interessant für Wissenschaft und Medizin.
Scientific support: Prof. Dr. Ralf Stumm
Published: 17.06.2021
Difficulty: intermediate
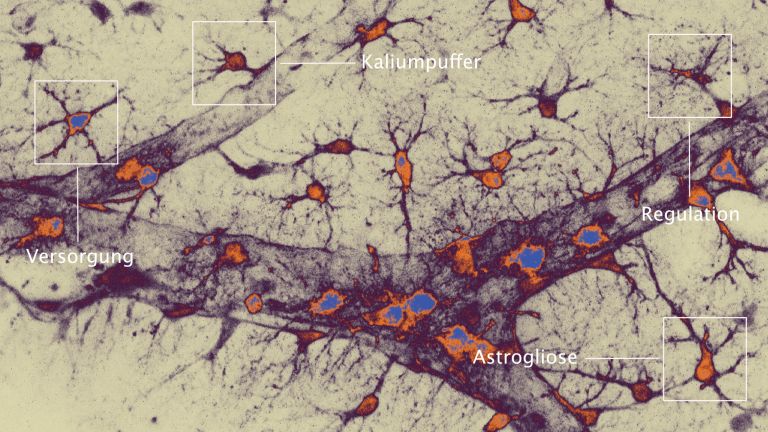
- Mikroglia sind die kleinsten Zellen des Nervensystems. Eine ihrer wichtigsten Aufgaben ist es, das umliegende Gewebe zu schützen.
- Die Mikroglia sind ständig aktiv und regulieren auch die Empfindlichkeit und Signalstärke der Nervenzellen. Solange es nicht zu größeren Verletzungen kommt, scheinen sie unauffällig und zuverlässig ihre Arbeit zu verrichten.
- Nach einem Schlaganfall tragen Mikroglia dazu bei, die Blut-Hirn-Schranke durchlässiger zu machen, und sie können regulatorische Immunzellen aus dem Körper dorthin locken.
- Der nachfolgende Entzündungsprozess kann sich verselbständigen. Forscher sehen hier einen möglichen Angriffspunkt für neue Therapien, es gibt aber noch keine Möglichkeit für zielgenaue Eingriffe.
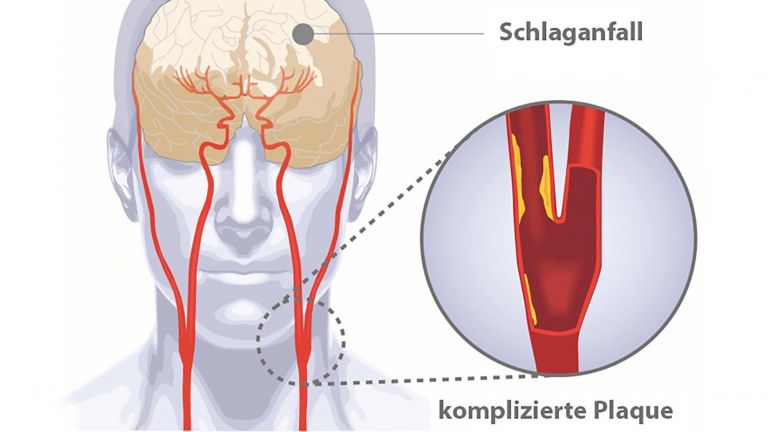
Ein Blutgefäß im Gehirn ist verstopft oder geplatzt, es fehlt an Nährstoffen und Energie, die Zellen sterben ab. Das klingt verständlich und einfach, ist es aber nicht. Durch den versiegenden Blutfluss werden ganze Kaskaden von Ereignissen ausgelöst, die seit Jahrzehnten Heerscharen von Forschern beschäftigen, und die doch noch längst nicht im Detail verstanden sind. Das gilt auch für die Rolle der kleinsten Zellen des Nervensystems, den Mikroglia. Im gesunden Gehirn passen sie auf, dass nichts das Gehirngewebe schädigt. Nach dem Schlaganfall schwingen sie selber das Schwert. Und hören einfach nicht auf damit.
Die Feuerwehr des Gehirns
Prof. Helmut Kettenmann vom Max-Delbrück-Zentrum für Molekulare Medizin in Berlin Buch untersucht seit über 40 Jahren Gliazellen und deren Funktionen. Er vergleicht die Rolle der Mikroglia unter Normalbedingungen mit der einer Feuerwehr: "Die holen mal eine Katze vom Baum, löschen ein kleines Brändchen oder pumpen einen Keller leer. Das kriegen die übrigen Bürger überhaupt nicht mit."
Dabei ist die Feuerwehr, sprich: die Mikroglia, nie inaktiv. Sie liegen in regelmäßigen Abständen verteilt zwischen anderen Zellen, strecken ihre Ausläufer aus und interpretieren darüber die Umgebungssignale. Diese kann man laut Kettenmann in zwei Kategorien einteilen: On- und Off-Signale: "On-Signale sind solche, die neu hinzukommen. Zum Beispiel Lipopolysaccharid." Dieses Molekül aus Bakterienmembranen ist wie ein Erkennungszeichen für Eindringlinge, die im Nervensystem nichts zu suchen haben. Kommen Mikroglia mit ihm in Kontakt, werden sie größer, nehmen eine amöboide Form an, und wandern zur Aktivierungsstelle. Und wenn es sich dabei um ein Bakterium handelt, nehmen sie es in sich auf und verdauen es. Nach getaner Arbeit wird die Zelle wieder inaktiviert.
Das Gegenstück zu den On-Signalen sind Off-Signale. Sie sind erst da und irgendwann weg. „Wir glauben, dass Neurotransmitter hier eine wichtige Rolle spielen, um der Mikroglia zu sagen, dass ihre Umgebung in Ordnung ist“, sagt Kettenmann. Solange die Neurone normal weiter signalisieren, ist alles gut. In diesem Zustand sind die Mikroglia aber dennoch aktiv. Sie beeinflussen die synaptische Aktivität der Nervenzellen, bauen Rezeptoren aus den Neuronen aus oder ein und regulieren so deren Empfindlichkeit und Signalstärke. "Unter physiologischen Bedingungen sind sie an plastischen Vorgängen beteiligt und helfen über Komplementfaktoren bei Umbauprozessen von Synapsen mit.", wie Kettenmann betont.
Werden Neurone aber zur Gefahr, weil sie hyperaktiv sind oder verletzt, dann können Mikroglia auch diese Zellen abbauen. Mikroglia sind nie völlig inaktiv. Beim Schlaganfall erwachen sie spätestens 30 bis 60 Minuten, nachdem der Blutfluss versiegt ist. Sie schütten dann Chemokine und Zytokine aus und bereiten so die Neuroinflammation vor. Die Vorsilbe "Neuro-" wird hier genutzt, um diese Vorgänge von der sonstigen Entzündung oder Inflammation außerhalb des Gehirns abzugrenzen. Die von Mikroglia ausgelösten Immunantworten sind nämlich etwas sanfter als die der Immunzellen aus dem Blut, kommen beispielsweise ohne Schwellung und Wärmeproduktion aus.
Im nächsten Schritt erweitern die Mikroglia mit so genannten Matrixmetalloproteinasen die Matrix zwischen den Zellen und machen sie durchlässiger. Im Normalbetrieb ist dies eine wichtige Funktion, damit sich die amöboiden Mikroglia hindurchquetschen können, um ihrer Arbeit nachzugehen. Allerdings bleiben im Gegensatz zum "normalen" Fall einer einzelnen eindringenden Bakterie nach einem Schlaganfall Lücken über vergleichsweise riesige Bereiche und ewige Zeiten. Nun wird das, was kurzfristig gut und wichtig war, zu einem Problem.
Recommended articles
Daueralarm an der Blut-Hirn-Schranke
Durch die Lücken können nämlich bestimmte Immunzellen schlüpfen, die normalerweise außen an den Zellwänden der Blut-Hirn-Schranke patrouillieren und vorfühlen, ob dahinter alles in Ordnung ist. Diese Zellen stoßen nun auf eine löchrige Wand in einer Umgebung, die geflutet ist mit Signalmolekülen und umgeben von aktivierten Mikroglia.
Die ersten Zellen, die von den Blutgefäßen in das Gehirngewebe eindringen, sind neutrophile Granulozyten. Es folgen Monozyten, T-Zellen, und B-Zellen. Sie alle können es sich in ihrer normalen Körperumgebung leisten, grob vorzugehen. Wird beim Heilungsprozess einer Schnittwunde mal eine Hautzelle zu viel entsorgt, macht das nichts. Im Gehirn sollte dies aber nicht passieren, schließlich brauchen wir die dortigen Nervenzellen zum Denken. Sie sollten also besser mit den dezenten Skalpellen der Mikroglia gerettet werden.
Umso verwunderlicher ist es, dass die Mikroglia nun ausgerechnet die „Grobiane“ unter den Immunzellen ruft. Kaum angekommen, beginnen diese, statt eines Skalpells die Sense zu schwingen. Auch die Mikroglia machen nun dabei mit, und zwar auf Dauer. Noch Jahre nach Schlaganfällen oder Hirntraumata lassen sich in betroffenen Bereichen aktivierte Mikroglia finden. Ob es sich bei der Einwanderung der Zellen ins Gehirn tatsächlich um einen „Unfall“ handelt oder um einen (oft erfolglosen) Rettungsversuch, ist noch nicht abschließend geklärt. Dies liegt auch daran, dass die Unterscheidung zwischen Mikroglia und eingewanderten Monozyten mit den verfügbaren Methoden nicht hinreichend genau ist. Vielleicht, so spekulieren manche Experten, ist es ja auch ein Fehlen der Monozyten, das die Situation beim Schlaganfall verschlechtert und die Mikroglia entweder überfordert oder in einen überreaktiven Zustand zwingt.
Arthur Liesz: "Wir haben erst in den letzten Jahren verstanden, dass es eine chronische Immunreaktion nach dem Schlaganfall gibt. Vorher dachte man, die Plastizität im Gehirn nach Verletzungen sei vor allem ein neuronaler Vorgang. Also etwas, bei dem man eingreifen kann mit neuronalen Wachstums- oder Plastizitätsfaktoren. Wir hatten lange einen sehr neurozentrischen Blick auf das Gehirn in der Regeneration nach Schlaganfall."
Daher war der Gedanke, die Entzündung therapeutisch zu dämpfen, so naheliegend. Und der Umstand, dass das nicht half, so aussagekräftig. Denn ohne Entzündung gibt es keine Reorganisation des Gewebes, also keine Heilung. Gleichzeitig muss das Gewebe auch vor schädlichen Einflüssen geschützt werden, damit es heilen kann. Auch das ist Aufgabe der Mikroglia: Sie produzieren eine Reihe protektiv wirkender Zytokine und neurotrophischer Substanzen wie IGF-1, die zur Regeneration und zum Überleben der Zellen nach Schäden beitragen.
Das Ziel: Die Regulation der Regulierer
An der nunmehr nicht mehr besonders wirksamen Blut-Hirn-Schranke sind allerdings nicht nur die Mikroglia tätig, sondern diese locken auch noch einen zweiten Trupp von Regulierern an, die zum Immunsystem des Körpers gehören, unter anderem regulatorische T-Zellen. Sie wandern in geschädigtes Gewebe ein und sorgen dort dafür, dass es zu keiner überschießenden Immunreaktion kommt. Sie bremsen die Entzündung bis zu einem Punkt, den man "resolution of inflammation" nennt - das Auflösen der Entzündung.
Dies ist ein aktiver Prozess, denn eine Entzündung hört nicht einfach so auf. Ihr Ende ist ebenso fein reguliert wie jeder andere ihrer Schritte. Die Wirkung der Signalmoleküle wird aufgehoben und am Ende begehen die letzten Immunzellen vor Ort kontrollierten Selbstmord. Erst dann ist die normale Ordnung wiederhergestellt. Dies gilt auch für die in das Gehirn eingewanderten regulatorischen T-Zellen, wie Liesz mit Kollegen 2009 in einer Publikation zeigen konnte. Nur scheint dieser Prozess nicht effizient genug zu sein. Die Entzündung wird nicht gebremst, sie wird chronisch.
Warum dieses scheinbare Chaos? Warum rufen die Mikroglia Immunzellen aus dem Blut, machen die Blut-Hirn-Schranke noch extra weit auf, damit eben die zu ihnen kommen, die von der Schranke zu recht draußen gehalten werden? Warum macht die Feuerwehr das Chaos perfekt? Ist das ein Fehler im System oder hat das einen Sinn, den wir nur noch nicht verstehen? Helmut Kettenmann erklärt das so: "Der Schlaganfall ist ein so massives Ereignis mit so dramatischem Schaden, der kommt normalerweise gar nicht vor. Im Lauf der Evolution geschah er sehr selten, weil die meisten Menschen kaum 40 Jahre alt wurden. Angesichts eines solch dramatischen Ereignisses sind die Regulierer vollkommen überfordert. Aber wie oft kommt das vor? Alle hundert Jahre einmal. Aus evolutionärer Sicht braucht es keine speziell vorbereitete Truppe für solch außergewöhnliche Ereignisse."
Ist also die chronisch gewordene Entzündung hier der Bösewicht? Arthur Liesz gibt zu. "Aktuell kann ich Ihnen nicht mal sagen, ob die chronische Neuroinflammation schädlich ist. Dazu müsste ich sie ausschalten, aber dafür habe ich keine therapeutischen Ansätze, weil sich die beteiligten Zellen und Moleküle bei Inflammation und Neuroinflammation so ähnlich sind."
Es ist die Janusköpfigkeit der Mikroglia, ihre zugleich positiven wie negativen Einflüsse zu unterschiedlichen Phasen nach dem Schlaganfall, die dafür sorgen, dass man mit einfachen Antworten nicht weiterkommt. Wen wundert's, dass es eben diese Doppelgesichtigkeit ist, die Mikroglia zugleich so attraktiv für Therapieansätze werden lassen. Arthur Liesz: "Wenn man die Zellen so manipulieren könnte, dass besonders die protektiven Funktionen im Vordergrund stehen, dann müsste die Regeneration besonders gut funktionieren – und genau daran arbeiten wir."
Zum Weiterlesen
- Dirnagl U et al.: Pathobiology of ischaemic stroke: an integrated view, TinS, 1999 Sep; 22(9): 391-7. [https://pubmed.ncbi.nlm.nih.gov/10441299/]
- Neuroglia, Third Edition, hg von Helmut Kettenmann und Bruce Ransom, Oxford University Press (2012).
- Rakers C, Petzold G: Astrocytic calcium release mediates peri-infarct depolarizations in a rodent stroke model, J Clin Invest. 2017 Feb 1; 127(2): 511–516. [https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5272189/pdf/jci-127-89354.pdf]
- Liesz A et al.: Regulatory T cells are key cerebroprotective immunomodulators in acute experimental stroke, Nat Med 2009 Feb; 15(2): 192-9. [https://pubmed.ncbi.nlm.nih.gov/19169263/]
- Populärwissenschaftliches Buch vom Autor dieses Textes: Ich glaub, mich trifft der Schlag, Ulrich Dirnagl, Jochen Müller, Droemer, München (2016)