RNA-Modifikation verantwortlich für die Störung der mitochondrialen Proteinsynthese bei der Alzheimer-Demenz
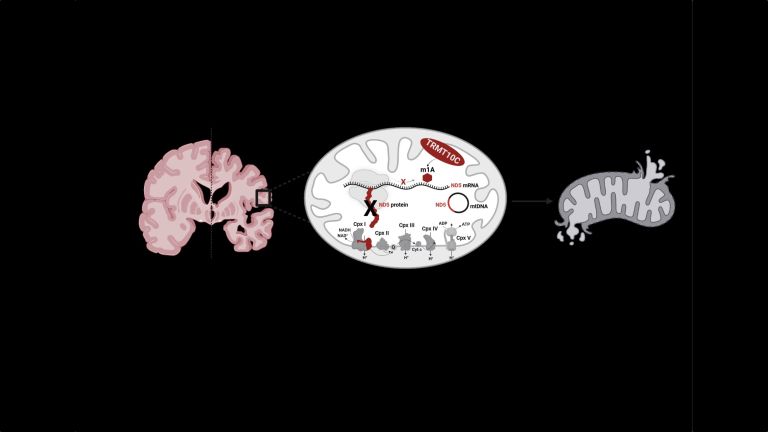
Methylierung von mRNA stört die Herstellung der Untereinheit ND5 von Komplex I der Atmungskette – Energieversorgung des Gehirns beeinträchtigt.
Veröffentlicht: 19.02.2024
Ein Forschungsteam der Johannes Gutenberg-Universität Mainz (JGU) hat einen Mechanismus entdeckt, wie es bei Alzheimer-Patienten zu einem Versagen der Mitochondrien kommt und damit zu einer reduzierten Versorgung des Gehirns mit Energie. „Es handelt sich hierbei um einen Effekt, der durch eine RNA-Modifikation vermittelt wird und der bisher unbekannt war“, teilt Prof. Dr. Kristina Friedland vom Institut für Pharmazeutische und Biomedizinische Wissenschaften der JGU dazu mit. Sie hat gemeinsam mit ihrem Kollegen Prof. Dr. Mark Helm diese Studie geleitet. Die Arbeit leistet damit einen Beitrag, um die Pathophysiologie der Alzheimer-Krankheit besser zu verstehen. An den Forschungen beteiligt waren auch Arbeitsgruppen der Universitätsmedizin Mainz, das Institut für Molekulare Biologie (IMB), die Universität von Lothringen und die Medizinische Universität Wien. Die Arbeit wurde in der renommierten Fachzeitschrift Molecular Psychiatry veröffentlicht.
„Kraftwerk der Zelle“ von Funktionsstörung betroffen
Mitochondrien, auch die „Kraftwerke der Zelle“ genannt, sind Organellen im Innern der Zellen, die im gesamten Körper, besonders aber im Gehirn für die Bereitstellung von Energie sorgen. So ist das Gehirn für seinen Energiebedarf zu 95 Prozent auf die Verstoffwechslung von Glucose in den Mitochondrien angewiesen. Seit Langem ist bekannt, dass bei der Alzheimer-Demenz die Glukose-Verstoffwechslung schon früh im Krankheitsprozess beeinträchtigt ist. Dem liegt eine Funktionsstörung der Mitochondrien zugrunde, die durch Alterungsprozesse und durch Amyloid-beta ausgelöst wird.
An der inneren Membran der Mitochondrien erfolgt durch eine Kette von aufeinanderfolgenden Reaktionen, die sogenannte Atmungskette, die Erzeugung von Energie in Form von Adenosintriphosphat. Daran sind über tausend Proteine beteiligt, die vom Zellkern zu den Mitochondrien transportiert werden. „Aber es gibt auch Proteine, die direkt in den Mitochondrien hergestellt werden. Dazu zählt ND5, eine Untereinheit im Komplex I der Atmungskette“, erklärt Kristina Friedland. Komplex I nimmt Elektronen von NADH auf und überträgt sie auf Ubichinon, wodurch Ubichinol gebildet wird. Dabei werden vier Protonen aus der Matrix in den Intermembranraum gepumpt. ND5 ist wichtig für diesen Prozess und Mutationen in dem mitochondrial kodierten Gen dieser Untereinheit führen zu schwerwiegenden mitochondrialen Erkrankungen wie zum Beispiel dem Leigh-Syndrom.
Bekannt ist bereits, dass an der mRNA, die für dieses Protein den Bauplan liefert, eine Methylierung stattfinden kann. Die mRNA ist in den Zellen für den Transport der Erbinformation und zusammen mit der tRNA für die Umsetzung in Proteine zuständig. Eine Methylierung erzeugt eine chemische Abänderung und führt dazu, dass mRNA und tRNA nicht mehr richtig interagieren können. „Die Synthese wird unterbrochen und es entsteht weniger Protein der Untereinheit ND5, die für den Komplex I von zentraler Bedeutung ist, weil hier der gesamte Prozess der Atmungskette beginnt“, so Friedland.
Enzym TRMT10C verursacht Methylierung und hemmt in der Folge die Synthese von ND5
Die Arbeitsgruppen Friedland und Helm am Institut für Pharmazeutische und Biomedizinische Wissenschaften konnten zeigen, dass das Enzym TRMT10C diese Methylierung und in der Folge die Unterdrückung von ND5 hervorruft. Sowohl im Zellmodell als auch im Gehirn von Alzheimer-Patienten war die Biosynthese von Proteinen der Untereinheit ND5 erniedrigt.
„Infolgedessen konnte hier zum ersten Mal nachgewiesen werden, dass die durch TRMT10C ausgelöste m1A-Methylierung der ND5-mRNA zu einer mitochondrialen Dysfunktion führt. Unsere Ergebnisse deuten darauf hin, dass dieser neu identifizierte Mechanismus an der Amyloid-beta-induzierten mitochondrialen Funktionsstörung beteiligt sein könnte“, schreiben die Autorinnen und Autoren in dem Beitrag in Molecular Psychiatry. Die Forschungen wurden aus Mitteln des Sonderforschungsbereichs/Transregio 319 „RMaP: RNA-Modifikation und Prozessierung“ gefördert.
Originalpublikation
Marko Jörg, Johanna E. Plehn et al.; N1-methylation of adenosine (m1A) in ND5 mRNA leads to complex I dysfunction in Alzheimer’s disease; Molecular Psychiatry, 29. Januar 2024
DOI: 10.1038/s41380-024-02421-y
https://www.nature.com/articles/s41380-024-02421-y