Hirntumore: „Gliome sind nicht heilbar“
Sie machen fast die Hälfte aller Hirntumoren aus: die Gliome. Im Interview spricht der Neurochirurg Michael Synowitz von der Berliner Charité über die großen Schwierigkeiten, solche Tumoren zu behandeln.
Veröffentlicht: 29.10.2014
Niveau: mittel
- Bei den Gliomen handelt es sich um eine Gruppe von Hirntumoren. Sie haben ihren Ursprung nach dem heutigen Kenntnisstand in den Vorläuferzellen der Gliazellen, die das Stütz- und Nährgewebe des Gehirns bilden.
- Anhand des prognostischen Verlaufs kann man hochgradige und niedriggradige Gliome unterscheiden: Hochgradige Gliome sind solche, die mit einer verkürzten Überlebenszeit einhergehen.
- Die Glioblastome sind die häufigsten bösartigen Tumoren des zentralen Nervensystems. Sie machen fast die Hälfte aller Gliome aus.
- Symptome können Kopfschmerzen, Schwindelgefühle oder Krampfanfälle sein. Es gibt aber für einen Hirntumor keine spezifische Symptomatik.
- Vermutlich stammen Gliome aus bestimmten Stammzellen. Es scheinen aber insgesamt verschiedene Zelltypen an den Gliomen beteiligt zu sein.
- Die meisten Gliome treten sporadisch auf, das heißt ohne erkennbaren familiären Zusammenhang. Die Veranlagung zu Gliomen ist also nicht vererbt, sondern die Tumoren werden durch Mutationen verursacht.
- Gliome sind nicht heilbar. Die durchschnittliche Überlebenszeit beim Glioblastom beträgt ab dem Zeitpunkt der Diagnose 15 Monate. Bei niedridgradigen Gliomen sind die Aussichten besser.
- In der Grundlagenforschung untersucht man derzeit, ob man mit bestimmten Stammzellen die Tumoren dazu bringen kann, sich zurückzuentwickeln.
Dr. Michael Synowitz ist Privatdozent und stellvertretender Klinikdirektor der Klinik für Neurochirurgie an der Charité Berlin. Nach seinem Studium der Medizin absolvierte er eine Facharztausbildung und arbeitete zugleich am Max-Delbrück-Centrum für molekulare Medizin in Berlin-Buch.
Empfohlene Artikel
Herr Dr. Synowitz, als Neurochirurg beschäftigen Sie sich mit einer besonderen Gruppe von Hirntumoren, den Gliomen. Zunächst einmal die Frage: Was sind eigentlich Gliome?
Michael Synowitz: Bei den Gliomen handelt es sich um eine Gruppe von Hirntumoren. Sie haben nach dem heutigen Kenntnisstand ihren Ursprung in den Vorläuferzellen der Gliazellen, die das Stütz– und Nährgewebe des Gehirns bilden. Man kann ein Gliom danach einteilen, welchem der verschiedenen Typen von Gliazellen der Tumor gewebetechnisch am ehesten ähnelt. So gibt es beispielsweise die Astrozytome, die ihren Ursprung in den Astrozyten haben. Außerdem gibt es die Oligodendrogliome, die den Oligodendrozyten gewebetechnisch ähneln. Man kann die Gliome aber auch anhand des prognostischen Verlaufs einteilen: Es gibt hoch– und niedriggradige Gliome, wobei hochgradige Tumoren mit einer kürzeren Überlebenszeit einhergehen. Meine Kollegen und ich konzentrieren uns in unserer Forschung auf die hochgradigen Gliome wie die Glioblastome.
Was ist denn das Besondere an den Glioblastomen?
Die Glioblastome sind die häufigsten bösartigen Tumore des zentralen Nervensystems. Sie machen fast die Hälfte aller Gliome aus. Das Glioblastom ist ein sehr heterogener Tumor, gekennzeichnet durch den Nachweis von pathologischen Blutgefäßen. Die Tumorzellen besitzen eine hohe Tendenz zur Ausbreitung und Durchwanderung des Gehirns. Glioblastome können völlig neu oder durch fortschreitende Differenzierung aus weniger bösartigen Astrozytomen entstehen.
Wenden wir uns wieder den Gliomen im Allgemeinen zu. Durch welche Symptome äußern sich Gliome?
Ob Entzündungen, Blutungen oder Hirntumore: Sie alle beanspruchen Raum im Gehirn und können beim Patienten zu den gleichen klinischen Symptomen führen: Kopfschmerzen, Schwindelgefühle oder Krampfanfälle. Die Symptome von Gliomen hängen unter anderem auch davon ab, welcher Bereich des zentralen Nervensystems betroffen ist. Das Problem ist also: Es gibt für einen Hirntumor keine spezifische Symptomatik. Man kann demnach nicht anhand des Beschwerdebilds ablesen, welche Erkrankung der Patient hat. Besonders die Glioblastome und die so genannten anaplastischen Astrozytome, ein weiteres bösartiges Gliom, sind sehr invasiv: Die Zellen beginnen sehr früh, in umliegende Hirnbereiche zu wandern. Es besteht dann das Risiko, dass sie weiter wachsen und neue Herde bilden. Das macht letztlich die Behandlung auch so schwierig. Man hat es mit keiner lokalen, auf einen bestimmten Bereich begrenzten Erkrankung zu tun.
Wie kann man ein Gliom wie das Glioblastom diagnostizieren?
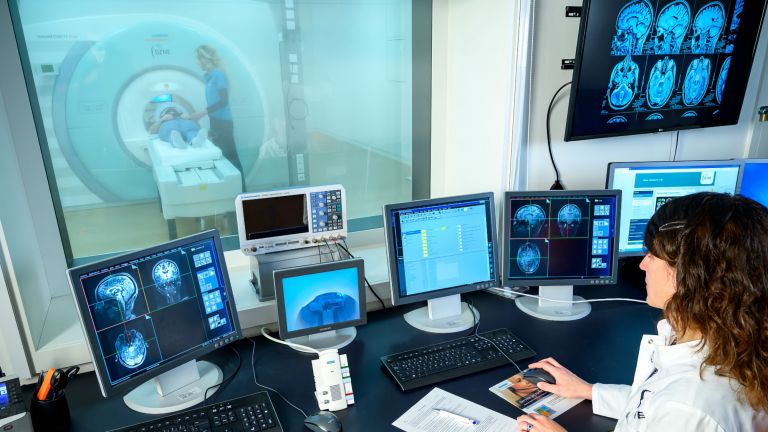
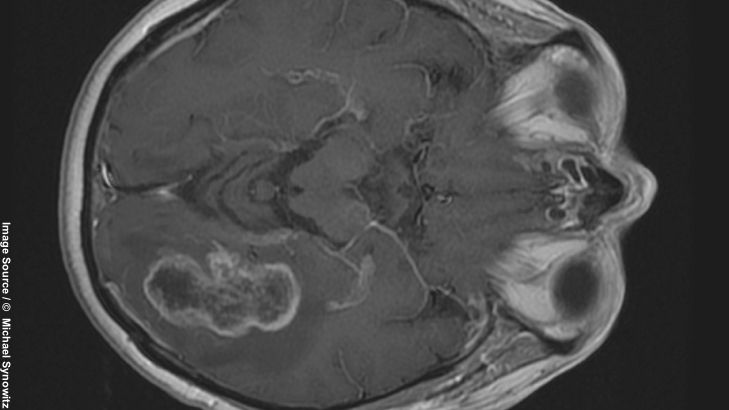
Mit Hilfe der Magnetresonanztomografie können wir Kontrastmittelaufnahmen erstellen. Hier sind Störungen der Blut-Hirn-Schranke zu sehen, die sich im Bereich des tumorverdächtigen Areals zeigen: Die Blut-Hirn-Schranke, die normalerweise den Blutkreislauf vom Gehirn trennt, ist aufgehoben und das Kontrastmittel kann vom Blut ins Gehirn diffundieren. Feingeweblich zeigt sich ein Zerfall von Zellen und eine vermehrte Gefäßneubildung.
Was weiß man denn bisher über die Ursachen von Gliomen?
Die gängige Lehrmeinung ist derzeit, dass es bis ins hohe Erwachsenenalter Nischen im Gehirn gibt, in denen neuronale Stammzellen vorhanden sind. Diese Stammzellen haben die Fähigkeit, sich teilen und damit vermehren zu können, ohne sich zu differenzieren. Hierbei, so die Annahme weiter, kommt es nun zu Fehlfunktionen. Aus manchen von ihnen werden „Tumorstammzellen“, also Tumore auslösende Stammzellen. Sie können sich weiterhin teilen und damit vermehren. Ihnen fehlen aber – anders als gesunden Stammzellen – bestimmte Absicherungsmechanismen. Gesunde Zellen wissen, dass sie ab einem bestimmten Punkt – wenn kein Bedarf mehr herrscht – sich nicht mehr teilen müssen. Dieses Wissen haben die erkrankten Zellen verloren und teilen sich unkontrolliert. Vermutlich stammen Gliome also aus solchen Stammzellen. Es scheinen aber insgesamt verschiedene Zelltypen an den einzelnen Gliomen beteiligt zu sein.
Welche Rolle spielen die Gene?
Die meisten Gliome treten ohne erkennbaren familiären Zusammenhang auf. Die Veranlagung zu Gliomen ist also nicht vererbt, sondern die Tumoren werden durch Mutationen verursacht. Es gibt eine Vielzahl bereits bekannter Mutationen, etwa die Veränderung eines Gens für einen Wachstumsfaktor. Diese Mutation sorgt dafür, dass sich Zellen stärker als normal teilen.
Welche Risikofaktoren von Gliomen sind denn bekannt?
Über die Risikofaktoren von Gliomen weiß man relativ wenig. Eine Zeit lang nahm man an, dass elektromagnetische Strahlung wie Handystrahlung eine negative Rolle spielen kann. Allerdings konnten große Studien hierzu keine endgültigen Belege dafür oder dagegen liefern. Von anderen Tumorarten wissen wir ganz gut, dass ionisierende Strahlungen zu Änderungen auf der Ebene von Chromosomen führen können. So konnte man feststellen, dass die Überlebenden der Atombomben-Abwürfe von Hiroshima und Nagasaki 10, 15 Jahre später verstärkt Tumoren entwickelt haben. Da wir über die Risikofaktoren wenig wissen, ist bisher leider auch keine Früherkennung möglich.
Wie sieht nun die Behandlung aus?
Bei den Glioblastomen steht am Anfang die Entfernung des bösartigen Gewebes. Man versucht natürlich, den Tumor möglichst vollständig zu entfernen. Doch das ist eine große Herausforderung. Besonders bei der OP ist es schwierig zu erkennen, wo der Tumor endet und wo gesundes Gewebe beginnt. Es gibt hier keinen glatten Rand wie bei einer Kugel, sondern einen fließenden Übergang. Dadurch verbleiben manche Zellen des Tumors fast zwangsläufig im Gehirn. Anschließend stehen eine Bestrahlung der erweiterten Tumorregionen und ebenso eine Chemotherapie an. Eine Studie hat kürzlich gezeigt, dass eine solche kombinierte Behandlung eine längere Überlebenszeit ermöglicht. Das ist also der Goldstandard, auf den man sich geeinigt hat.
Und wie geht man vor, wenn der Tumor wiederkommt?
Wenn der Tumor wiederkommt, aber auch bei der Behandlung der niedriggradigen Tumoren oder der anaplastischen Astrozytome, wird die Wahl der Behandlung schwieriger. Es ist dann wesentlich schwieriger, zwischen bildgebenden Veränderungen durch die Chemo-und Strahlentherapie und dem bildgebenden Verdacht auf ein neues Tumorwachstum zu unterscheiden. Hier gibt es vielfältige Diskussionen über die bestmögliche Behandlung und man versucht gerade, Leitlinien zu entwickeln, also Behandlungsempfehlungen ohne bindende Wirkung für die Ärzte.
Wie sind die Prognosen bei Gliomen bei einer entsprechenden Behandlung?
Gliome sind nicht heilbar. Die durchschnittliche Überlebenszeit beim hochgradigen Glioblastom beträgt ab dem Zeitpunkt der Diagnose 15 Monate; ohne Behandlung wären es etwa drei Monate. Es gibt aber eine große Spannweite. Mehr als fünf Jahre nach Diagnosestellung leben noch rund fünf Prozent der Patienten mit einem Glioblastom. Bei niedridgradigen Gliomen sind die Aussichten besser: Rund 80 Prozent der Patienten mit einem Oligodendrogliom leben länger als fünf Jahre.
Gibt denn die Grundlagenforschung Anlass zur Hoffnung auf neue Therapien?
Meine Kollegen und ich konnten in den letzten Jahren zeigen, dass Gliome auch zu einer Aktivierung hirneigener Stammzellen in den Stammzell-Nischen führen können. Diese Stammzellen unterscheiden sich von den entarteten Tumorstammzellen: Sie wandern zum Tumor hin, erkennen ihn und schütten dort Botenstoffe aus. Die Botenstoffe sagen gewissermaßen den Tumorstammzellen, dass sie sich zu einer bestimmten differenzierten Zelle entwickeln sollen. Damit verlieren diese eine ihrer Haupteigenschaften, nämlich sich unkontrolliert teilen zu können. Mit zunehmendem Lebensalter scheinen allerdings Stammzellen die Fähigkeit zu verlieren, zu Tumoren im Gehirn zu wandern. Damit büßt auch das Gehirn die Fähigkeit ein, auf Tumor-Erkrankungen zu reagieren. Das könnte auch erklären, warum viele Gliome erst ab dem 60. Lebensjahr auftauchen. Das Gehirn verliert bis zu diesem Zeitpunkt seine Fähigkeit, Stammzellen zu reproduzieren.
Wie könnte nun auf dieser Grundlage eine Therapie aussehen?
Im Tiermodell bei alten Tieren konnten wir gewissermaßen die Situation wieder so herstellen wie bei jungen Tieren, indem wir ihnen Stammzellen gegeben haben. Daraufhin haben sich die Tumore zurückentwickelt.
Und beim Menschen?
Beim Menschen ist die Idee, das Stammzellen-Potenzial von älteren Menschen zu regenerieren, damit es dem von jungen Menschen ähnelt. Dazu müssen wir aber noch klinische Studien durchführen.
Herr Dr. Synowitz, vielen Dank für das Gespräch.
Gliazellen
Gliazellen/-/glia cells
Gliazellen stellen neben den Neuronen die zweite Gruppe große Gruppe von Zellen im Gehirn. Sie wurden lange Zeit als die inaktiven Elemente des Gehirns, als „Nervenkitt“ bezeichnet. Heute weiss man, dass die verschiedenen Typen von Gliazellen (Astrozyten, Oligodendrozyten und Mikrogliazellen) klar definierte Aufgaben im Nervensystem erfüllen. So reagieren sie z. B. auf Krankheitserreger, spielen eine wichtige Rolle bei der Ernährung der Nervenzellen oder isolieren Nervenfasern. Ihr Anteil im Vergleich zu den Neuronen liegt bei etwas über 50 Prozent.
Astrozyt
Astrozyt/-/astrocyte, astroglia
Astrozyten sind die größten unter den Gliazellen. Zu ihren Aufgaben gehören z.B. die Immunabwehr (auch Blut-Hirn-Schranke) oder die Wiederaufnahme ausgeschütteter Neurotransmitter (Botenstoffen im Gehirn).
Oligodendrozyten
Oligodendrozyten/-/oligodendrocytes
Zellen des Zentralen Nervensystems, die die Myelinscheide um die Nervenzellen bilden und so deren Leitungsgeschwindigkeit erhöhen. Sie gehören zu den Gliazellen.
Magnetresonanztomographie
Magnetresonanztomographie/-/magnetic resonance imaging
Ein bildgebendes Verfahren, das Mediziner zur Diagnose von Fehlbildungen in unterschiedlichen Geweben oder Organen des Körpers einsetzen. Die Methode wird umgangssprachlich auch Kernspin genannt. Sie beruht darauf, dass die Kerne mancher Atome einen Eigendrehimpuls besitzen, der im Magnetfeld seine Richtung ändern kann. Diese Eigenschaft trifft unter anderem auf Wasserstoff zu. Deshalb können Gewebe, die viel Wasser enthalten, besonders gut dargestellt werden. Abkürzung: MRT.
Gen
Gen/-/gene
Informationseinheit auf der DNA. Den Kernbestandteil eines Gens übersetzen darauf spezialisierte Enzyme in so genannte Ribonukleinsäure (RNA). Während manche Ribonukleinsäuren selbst wichtige Funktionen in der Zelle ausführen, geben andere die Reihenfolge vor, in der die Zelle einzelne Aminosäuren zu einem bestimmten Protein zusammenbauen soll. Das Gen liefert also den Code für dieses Protein. Zusätzlich gehören zu einem Gen noch regulatorische Elemente auf der DNA, die sicherstellen, dass das Gen genau dann abgelesen wird, wenn die Zelle oder der Organismus dessen Produkt auch wirklich benötigen.